 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
Самостійна робота на занятті.
Виконати лабораторні роботи:
1. Визначення зміни температури при розчиненні і взаємодії між речовинами.
2. Розрахувати ентальпію і енергію Гіббса для досліджуваних процесів.
3. Оформити і захистити протокол.
Методика виконання роботи
Робота 1. Визначення ентальпії розчинення солі.
У зважений калориметр наливають 100 мл води і вимірюють температуру з точністю до 0,1 градуса. Розчиняють у цій воді 5 г. солі на протязі 3-х хв. і вимірюють температуру розчину. Використовуючи числові дані, які заносять в табл. 1, і значення молярних теплоємностей (Ср) речовин із “Довідника з хімії”, які приймали участь в теплообміні, визначають теплоту розчинення солі (DН) за формулою:
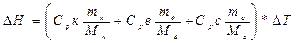 (1)
(1)
де Срк, Срв, Срс – молярні теплоємності алюмінію з якого зроблений калориметр, води і дослідженої солі;
 Т – зміна температури;
Т – зміна температури;
mк, mв, mс – маси калориметра, води і досліджуваної солі;
Мк, Мв, Мс - молярні маси речовини з якої виготовлений калориметр, води і досліджуваної солі;
 Н – зміна ентальпії при розчинені солі (теплота розчинення).
Н – зміна ентальпії при розчинені солі (теплота розчинення).
Табл. 1
| mАІ | Ср (АІ) | mв | Ср(в) | mс | Ср(с) | tпоч. | tкін. |  t t
|  Н Н
|
Робота 2. Визначення ентальпії утворення кристалогідрату з безводної солі і води.
Процес утворення розчинів соди із безводної солі і кристалогідрату можна відобразити рівняннями:
A(к.) + aq = A(р.)  Н1
Н1
A*nH2O(к.) + aq = A(р.)  Н2
Н2
Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
A (к.) + nH2O = A*nH2O  Н3 =
Н3 =  Н1 -
Н1 -  Н2
Н2
Беруть наважки безводної солі і кристалогідрату (5-10) г. з точністю до 0,01 г. В калориметричну посудину наливають 150 мл дистильованої води і закріплюють в калориметричному стакані. Вимірюють початкову температуру. Потім в калориметричну посудину вносять наважку безводної солі, розчиняють її та фіксують зміну температури. За формулою (1) визначають  Н1
Н1
Аналогічно проводять визначення ентальпії розчинення кристалогідрату  Н2
Н2
В протоколі виконують відповідні розрахунки, використовуючи наведене в роботі рівняння і роблять відповідні висновки.
Робота 3. Визначення ентальпії реакції взаємодії оксиду кальцію з ортофосфорною кислотою.
В калориметричну посудину заливають 50 мл 0,1 н розчину Н3РО4 і вимірюють температуру. Зважують на аналітичних вагах 0,5 г СаО і при перемішуванні вносять його в розчин ортофосфорної кислоти. Записують найвищу температуру, яку покаже термометр в результаті реакції.
Обчислення ентальпії реакції взаємодії проводять за формулою:
Поиск по сайту: