 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Несахарный диабет
В почках отсутствует рецептор к антидиуретическому гормону, что → к нарушению реабсобрции воды, полиурии и дегидратации.
Патология внутриутробного развития.
Возникает в результате воздействия на организм матери повреждающих факторов во время беременности, или в результате заболеваний матери. Особенности патологии внутриутробного периода зависят от характера повреждающего фактора и периода внутриутробного развития в который действует повреждающий фактор.
Периоды внутриутробного развития:
Оплодотворение и преимплантация (1 – 6 день).
Имплантация (6 – 12 день)
Бластогенез (первые 2 недели)
 Эмбриогенез (по 12 неделю) ранний (до 6 недели)
Эмбриогенез (по 12 неделю) ранний (до 6 недели)
Поздний (до 12 недели)

 Фетальный (13 неделя – 40 неделя) ранний (до 29 недели)
Фетальный (13 неделя – 40 неделя) ранний (до 29 недели)
поздний (с 29 недели – роды 40 неделя)
В периоды преимплантации, имплантации и бластогенеза действует закон «все или ничего». Либо беременность прерывается, либо действующий неблагоприятный фактор не вызывает повреждения и беременность развивается нормально. В ранний эмбриональный период тоже чаще всего действует закон «все или ничего». В поздний эмбриональный период развиваются грубые системные пороки развития.
В ранний фетальный период развиваются пороки развития ЦНС (гидроцефалия, микроцефалия)
В поздний фетальный период ребенок полностью сформирован, пороков развития не бывает, но возникают инфекционные и неинфекционные фетопатии.
Гаметопатии - патология половых клеток. Может сопровождаться повреждением ДНК, тогда проводит к развитию наследственных болезней. Может сопровождаться нарушением подвижности сперматозоидов или их способности к оплодотворению, тогда беременность не возникает.
Эмбриопатии –
2-6 неделя - ранние эмбриопатии, характеризуются множественными грубыми системными пороками развития которые обычно не совместимы с внутриутробным развитием и приводят к выкидышам.
5-12 неделя - позние эмбриопатии приводят к системным порокам развития внутренних органов.
Фетопатии
13-28 неделя – раннии фетопатии проявляются пороками развития ЦНС (гидроцефалия) либо изолированными пороками развития внутренних органов.
29-40 неделя- поздние фетопатии - ребенок полностью сформирован, пороков развития не бывает, но возникают инфекционные и неинфекционные болезни.
Инфекционные фетопатии – проявляются врожденными инфекционными болезнями (врожденный сифилиз, врожденный токсоплазмоз, врожденный гепатит и тд)
Неинфекционные фетопатии – гипоксия, гипотрофия, эндокринопатии, гемолитическая болезнь новорожденных (резус-конфликт) и т.д.
Гаметопатии – патология половых клеток. Может сопровождаться повреждением ДНК, тогда возникают наследственные болезни. Может сопровождаться нарушением подвижности сперматозоидов или их способности к оплодотворению, тогда беременность не наступает.
Эмбриопатии
Ранние эмбриопатии -2-6 неделя беременности - сопровождаются множественными грубыми системными пороками развития которые обычно несовместимы с внутриутробным развитием и приводят к выкидышам.
Поздние эмбриопатии 6-12 неделя – сопровождаются множественными системными пороками развития внутренних органов.
Фетопатии
Ранние фетопатии 13-28 неделя – проявляются пороками развития ЦНС, либо изолированными пороками развития отдельных органов.
Поздние фетопатии 29-40 неделя ребенок полностью сформирован, пороков развития не бывает, но могут возникать инфекционные и неинфекционные болезни.
Инфекционные фетопатии – проявляются врожденными инфекционными болезнями (врожденный сифилиз, токсоплазмоз, цитомегаловирусная инфекция, гепатит)
Неинфекционные фетопатии – гипоксия, гипотрофия, эндокринопатии, гемолитическая болезнь новорожденных(резус-конфликт)
ЛЕКЦИЯ № 6.
ТЕМА: ПАТОЛОГИЯ КИСЛОТНО – ОСНОВНОГО СОСТОЯНИЯ (КОС).
Под КОС понимают отношение между поступлением в организм, образованием и выведением из организма кислот и оснований.
Кислоты – это соединения, которые в реакциях являются донорами протонов водорода.
Основания – это соединения, которые являются акцепторами протонов водорода.
КОС определяют по pH крови. рН – это отрицательный десятичный логарифм концентрации протонов водорода. При увеличении рН повышается щелочность раствора, развивается алкалоз, при уменьшении рН увеличивается кислотность раствора, развивается ацидоз.
В норме (при стандартных условиях) рН артериальной крови: 7,37 – 7, 43.
Изменение рН на 0,1 приводит к грубым нарушениям жизненно важных функций. Изменение на 0,3 не совместно с жизнью. Поэтому в организме существуют мощные регуляторные системы, отвечающие за поддержание рН крови. Регуляция КОС осуществляется при участии буферных систем крови и органов утилизации и выделения кислот и оснований.
БУФЕРНЫЕ СИСТЕМЫ КРОВИ.
Буферная система – раствор слабо диссоциируемой кислоты и сопряжённого с ней, хорошо растворимого, основания.

 НА Н+ + А-
НА Н+ + А-
Буферные системы подчиняются закону действующих масс. При повышении концентрации кислоты происходит повышение скорости прямой реакции, т.е усиливается диссоциация. При повышении концентрации оснований возрастает скорость обратной реакции. Т.е. в растворе устанавливается равновесие между содержанием кислоты и оснований.
К буферным системам крови относят:
1.Бикарбонатная буферная система – 53% буферной емкости крови
Представлен слабо диссоциируемой угольной кислотой и сопряженным с ней основанием бикарбонатом



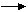 СО2 + Н2О Н2СО3 Н+ + НСО-3
СО2 + Н2О Н2СО3 Н+ + НСО-3
2. Белковая буферная система
Представлена альбуминами и гемоглобином, которые могут связывать протоны превращаясь в кислоту и отдавать протоны превращаясь в основания (протеинаты)

 PtH H+ + + Ht –
PtH H+ + + Ht –
 |

 AlH H+ + Al- 7 -10% альбуминовая буферная система
AlH H+ + Al- 7 -10% альбуминовая буферная система
 HbH H + + Hb- 35% гемоглобиновая буферная система
HbH H + + Hb- 35% гемоглобиновая буферная система
протеинаты
3.Фосфатная буферная система - 5% буферной емкости крови
Представлена одноосновным (кислота) и двухосновным (основание) фосфат анионами.

 Н2 РО4 -- Н+ + НРО4 2—
Н2 РО4 -- Н+ + НРО4 2—
БУФЕРНЫЕ ОСНОВАНИЯ КРОВИ.
Под буферными основаниями крови (ВВ) понимают совокупность анионов всех буферных систем крови, но учитывая, что ёмкость фосфатного буфера низкая, фосфат – анионами пренебрегают. Т.о буферные основания крови – это совокупностью бикарбоната и протеинатов крови. В норме содержание буферных оснований 48±2,5 ммоль/л. ±2,5 ммоль/л называют сдвигом буферных оснований (ВЕ).
Особенность ВВ в том, что их концентрация не меняется при изменении напряжения СО2 в крови, поэтому по изменениям концентрации буферных оснований можно судить о наличии нереспираторных нарушений КОС.
ОРГАНЫ УЧАСТВУЮЩИЕ В РЕГУЛЯЦИИ КОС.
1. Дыхательная система участвует в регуляции КОС, изменяя напряжения СО2 в крови. Тесно связана с бикарбонатным буфером. При снижении частоты дыхания увеличивается концентрация СО2 в крови, что приводит к повышению концентрации Н2СО3 , развивается ацидоз. При повышении частоты дыхания снижается напряжение СО2, сжижается количество Н2СО3 , развивается алкалоз.
2. Почки. Участвуют в регуляции КОС, т.к осуществляют реабсорбцию бикарбоната, секрецию протонов водорода и экскрецию с мочой нелетучих кислот и оснований.
МЕХАНИЗМЫ:
Под действием карбоангидразы происходит реабсорсбция Na и бикарбоната, и секреция с выведением из организма Н+.
Под действием альдостерона происходит реабсорбция Na и секреция ионов калия и водорода.
Переход однозамещённых фосфатов в двухзамещённые, при этом связываются ионы водорода.
Ионы водорода связываются в процессе аминоацидгенеза.
В процессе образования иона аммония (аммонийацидгенез)
3.ЖКТ.
В желудке происходит секреция ионов водорода и хлора в обмен на всасывание бикарбоната. В кишечнике секреция бикарбоната и всасывается соляная кислота. В норме этот процесс в равновесии, но при изолированной потере или желудочного или кишечного сока могут возникать нарушения КОС.
4.Печень.
Утилизирует молочную кислоту и аминокислоты, поступающие из ЖКТ.
Выводит в составе желчи нелетучие кислоты и основания.
Инактивирует аммиак.
Синтезирует альбумины (компоненты буферной системы)
Инактивирует альдостерон
5.Кожа. При нарушении функции почек может в незначительном количестве в составе пота выводить кислоты и основания.
Классификация нарушений КОС.
1. Ацидоз - сдвиг в кислую сторону
2.Алкалоз – сдвиг в щелочную сторону
1. Респираторные нарушения КОС
2. Нереспираторные нарушения КОС
Нереспираторный ацидоз бывает: экзогенным, метаболическим и экскреторным
Нереспираторный алкалоз бывает: экзогенным и экскреторным (метаболического нет, т.к. щелочи в организме не накапливаются)
Выделяют простые нарушения КОС, смешанные формы и комбинированные формы
Смешанные формы показывают на то, что в организме запускаются механизмы компенсации
Бывают 4 типов.
Первичный респираторный ацидоз и вторичный нереспираторный алкалоз
Первичный нереспираторный ацидоз и вторичный респираторный алкалоз
Первичный респираторный алкалоз и вторичный нереспираторный ацидоз
Первичный нереспираторный алкалоз и вторичный респираторный ацидоз.
Нормы КОС
РН крови 7,4±0,05
Напряжение CO2 40 ±5 мм.рт. ст.
ВВ (буферные основания крови) 48±2,5ммоль/л
ВЕ (сдвиг буферных оснований) ±2, 5ммоль/л
SB (стандартный бикарбонат) 24±3ммоль/л





 рН 7,35 7,4 7,45
рН 7,35 7,4 7,45
ацидоз алкалоз
7,35 – 7,4 – компенсированный ацидоз
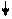 7,35 – декомпенсированный ацидоз
7,35 – декомпенсированный ацидоз
7,4 – 7,45 – компенсированный алкалоз
 7,45 – декомпенсированный алкалоз
7,45 – декомпенсированный алкалоз
N

 35 40 45
35 40 45



 СО2
СО2
Респираторный алкалоз респираторный ацидоз

 -2,5 0 +2,5
-2,5 0 +2,5



 ВЕ
ВЕ
Нереспираторный ацидоз нереспираторный алкалоз
РЕСПИРАТОРНЫЙ АЦИДОЗ.
Характеризуется повышением в крови напряжения СО2 более 45 мм.рт.ст. Может возникать при нарушении внешнего дыхания (нарушение альвеолярной вентиляции, диффузии газов в лёгких, перфузии крови по сосудам лёгких), при дыхании воздухом, содержащим высокие концентрации СО2 (герметически закрытые помещения (под завалами), неисправный наркозный аппарат).
При данном нарушении из- за неспособности дыхательной системы обеспечить нормальное напряжение СО2 компенсацию берут на себя почки, за счёт повышения реабсорбции бикарбоната и секреции протонов водорода. Увеличение реабсорбции бикарбонатов приводит к увеличению содержания буферных оснований в крови. При этом сдвиг буферных оснований становится более 2,5 ммоль/л, развивается смешанная форма нарушений КОС, когда первичный респираторный ацидоз компенсируется вторичным нереспираторным алкалозом.
НЕРЕСПИРАТОРНЫЙ АЦИДОЗ.
Характеризуется смещением сдвига буферных оснований меньше -2,5 ммоль/л.
Выделяют 3 формы:
Экзогенный ацидоз- при увеличенном поступлении в организм кислот (отравление кислотами, избыточный прием кислых продуктов - пища, лекарственные препараты)
Метаболический ацидоз - при усиленном образовании кислот. Может быть лактатацидоз (молочная кислота накапливается при гипоксии и чрезмерных физических нагрузках) и кетоацидоз (кетоновые тела накапливаются при голодании и сахарном диабете)
Экскреторный ацидоз – при нарушение выведения кислот или при повышенной потере щелочей. Нарушение выведения кислот из организма может быть вызвано нарушением функции почек, эндокринной системы (гипокортицизм, гипоальдеростенизм, почечная недостаточность), потеря щелочей происходит с кишечным соком (при диарее, фистулах ЖКТ).
Компенсация осуществляется за счет увеличения частоты дыхания, при этом уменьшается напряжение СО2 в крови ниже 35 мм.рт.ст. и развивается смешанная форма, когда первичный нереспираторный ацидоз компенсируется вторичным респираторным алкалозом.
КОМБИНИРОВАННЫЙ АЦИДОЗ.
Наблюдается при сочетании респираторного и нереспираторного ацидоза. Напряжение СО2 в крови выше 45 мм.рт.ст, а сдвиг буферных оснований меньше -2,5 ммоль/л. Компенсация затруднена, поэтому комбинированный ацидоз обычно декомпенсированный.
НАРУШЕНИЯ В ОРГАНИЗМЕ ПРИ АЦИДОЗЕ.
Расширение сосудов и увеличение их проницаемости приводит к отёку лёгких и головного мозга;
Гиперкальциемия и гиперкалиемия (нарушение работы сердца приводит к брадикардии вплоть до остановки сердца); снижение чувствительность адренорецепторов к катехоламинам сопровождается гипотензией, спазм бронхиол и гиперсекреция слизи приводит к обструкции бронхов и гипоксии.
РЕСПИРАТОРНЫЙ АЛКАЛОЗ.
Возникает при снижении напряжения СО2 в крови ниже 35 мм.рт.ст. Причины: гипервентиляция (при горной болезни, при раздражении дыхательного центра, при неправильно проведённой искусственной вентиляции лёгких). Компенсация за счёт почек: снижается реабсорбция бикарбоната и секреция Н+. Снижение реабсорбции бикарбоната приводит к смещению сдвига буферных оснований меньше -2,5 ммоль/л. Развивается смешанная форма нарушения КОС, когда первичный респираторный алкалоз компенсируется вторичным нереспираторным ацидозом.
НЕРЕСПИРАТОРНЫЙ АЛКАЛОЗ.
Развивается при увеличении в крови сдвига буферных оснований больше 2,5 ммоль/л.
Бывает:
Экзогенный алкалоз - при повышенном поступлении в организм щелочей (при отравлении щелочами, при избыточном приёме щелочных растворов для купирования изжоги).
Экскреторный алкалоз - при усиленной потери из организма кислот. Через ЖКТ при неукротимой рвоте, через почки при гиперальдестронизме, гиперкортицизме, гипофункции паращитовидных желёз.
Компенсация при нереспираторном алкалозе осуществляется за счёт снижения частоты дыхания, при этом напряжение СО2 в крови становится больше 45 мм.рт.ст, развивается смешанная форма, когда первичный нереспираторный алкалоз компенсируется вторичным респираторным ацидозом.
КОМБИНИРОВАННЫЙ АЛКАЛОЗ.
Сочетание респираторного и нереспираторного алкалоза. Является самой редкой и тяжёлой формой нарушения КОС, всегда декомпенсирован. При этом напряжение СО2 в крови меньше 35 мм.рт.ст,а сдвиг буферных оснований больше 2,5 ммоль/л.
НАРУШЕНИЯ В ОРГАНИЗМЕ ПРИ АЛКАЛОЗЕ.
Возникает спазм сосудов, в том числе и головного мозга, что приводит к гипоксии ЦНС. Развивается гипокалиемия, приводящая к аритмии и тахикардии, гипокальциемия приводящая к судорогам, тетании, ларингоспазму и асфиксии.
НАРУШЕНИЕ ВОДНО- ЭЛЕКТРОЛИТНОГО ОБМЕНА.
Все процессы протекают в водной среде. В в организме взрослого человека содержится от 57 – 60% воды. Вся жидкость делится на внутриклеточную (2/3) и внеклеточную (1/3). Внеклеточная жидкость представлена кровью, лимфой, интерстициальной жидкостью, трансцеллюлярной жидкостью, к которой относится спинномозговая жидкость, внутриглазная, внутрисуставная, жидкость серозных полостей и ЖКТ.
Электролитный состав внутри и вне клетки отличается. Внутри – К+, фосфаты, мало натрия, хлоридов, бикарбонаты, кальция. Во внеклеточной много натрия, хлоридов, мало калия и кальция.
Регуляция осуществляется с помощью антидеуретического горона и альдостерона. АДГ синтезируется в гипоталамусе в супраоптических и паравентрикулярных ядрах в ответ на изменение осмотической концентрации плазмы. Выделяется из нейрогипофиза, действует на рецепторы дистальных почечных канальцев и собирательных трубочек, вызывая реабсорбцию воды. Альдостерон секретируется в клубочковой зоне коры надпочечников в ответ на активацию ренин – ангиотензиновой системы и повышает в крови концентрацию ангиотензина 2. Альдостерон действует на рецепторы почечных канальцев, вызывая реабсорбцию натрия, вместе с которым пассивно задерживается вода, также вызывает секрецию и выведение из организма ионов калия и водорода.
КЛАССИФИКАЦИЯ НАРУШЕНИЙ ВЭО.
Обмен воды в организме тесно связан с обменом натрия, поэтому рассматриваются совместно.
Гипогидротация 1.изоосмолярная 2.гипоосмолярная 3.гиперосмолярная.
Гипергидратация 1. Изоосмолярная 2.гипоосмолярная 3.гиперосмолярная.
ИЗООСМОЛЯРНАЯ ГИПОГИДРАТАЦИЯ.
Возникает при потере воды и натрия в пропорциональных количествах, т.е при потере изотонической жидкости.
Причины:
Острая кровопотеря,
Высокая кишечная непроходимость,
Полиурия изотонической мочой (при нарушении функции канальцев без нарушения функции клубочков).
Снижается объём циркулирующей крови, что приводит к развитию гиповолемического шока. Из-за потери жидкости увеличивается вязкость крови, это приводит к нарушению микроциркуляции и ещё больше усугубляет нарушение кровообращения, способствующего развитию гипоксии.
ГИПООСМОЛЯРНАЯ ГИПОГИДРОТАЦИЯ.
Возникает, когда потери натрия превышают потери воды, т.е при потере гипертонической жидкости.
Причины:
Интенсивное потоотделение,
Диарея (при поражении толстого кишечника),
Неукротимая рвота,
при гипоальдестеронизме, гипокортицизме
Осмотическое давление плазмы уменьшается, что приводит к переходу жидкости из внеклеточного пространства во внутриклеточное, развивается клеточный отёк, отёк головного мозга.
ГИПЕР ОСМОЛЯРНАЯ ГИПОГИДРОТАЦИЯ.
При преимущественной потере воды. Бывает при:
Обширных ожогах
Несахарном диабете (из- за нарушения секреции АДГ)
При нарушении поступления в организм воды
При длительной гипервентиляции лёгких
При этом из-за гиперосмолярной плазмы происходит перераспределение жидкости из внутриклеточного пространства во внеклеточное. Развивается клеточная дегидратация.
ГИПЕРГИДРАТАЦИЯ ИЗООСМОЛЯРНАЯ.
Развивается крайне редко из-за врачебных ошибок при избыточном переливании изотонических растворов. В нормально функционирующем организме быстро устраняется, но когда есть нарушение функции почек может развиваться даже при незначительном переливании изотонического раствора. При этом увеличивается объём циркулирующей крови, происходит развитие сердечной недостаточности и отёков.
ГИПО ОСМОЛЯРНАЯ ГИПЕРГИДРАТАЦИЯ.
Возникает при увеличенном поступлении в организм воды, при промывании ЖКТ чрезмерными количествами жидкости или при утоплении в пресной воде, с последующей реанимацией. При избыточной продукции АДГ. Из- за гипоосмолярности плазмы происходит перераспределение жидкости внутрь клетки с развитием клеточного отёка. Опасно развитие отёка головного мозга и лёгких. При утоплении в пресной воде гипоосмолярность плазмы может быть настолько выражена, что приводит к гемолизу эритроцитов.
ГИПЕР ОСМОЛЯРНАЯ ГИПЕРГИДРАТАЦИЯ.
Возникает при увеличенном поступлении в организм гипертонической жидкости (избыток натрия). Возникает при гиперкортицизме, гиперальдестеронизме, утопление в солёной воде с последующей реанимацией. Из-за гиперосмолярности плазмы происходит перераспределение жидкости из клетки во внеклеточное пространство, в результате чего может возникнуть клеточная дегидратация.
ПАТОЛОГИЯ ОБМЕНА КАЛИЯ И КАЛЬЦИЯ.
КАЛИЙ – основной внутриклеточный ион, участвующий в формировании потенциала действия.
ГИПОКАЛИЕМИЯ
При его недостаточном поступлении в организм (голодание, его дефицит в пище)
При его перераспределении из плазмы во внутриклеточное пространство – бывает при алкалозе, при передозировке глюкозо –инсулиновой смеси.
При повышенной потере из организма – гиперальдостеронизм, гиперкортицизм.
При гипокалиемии развивается тахикардия, аритмия, артериальная гипотензия, судороги.
ГИПЕРКАЛИЕМИЯ.
При повышенном поступлении (передозировка препаратами калия)
При усиленном выходе его из клетки в плазму – при обширных некрозах, ацидозе.
При нарушении выведения его из организма (ацидоз, гипоальдестеронизм, гипокортицизм)
При гиперкалиемии развиваются брадикардия, вплоть до остановки сердца.
ГИПОКАЛЬЦИЕМИЯ.
При недостаточном поступлении с пищей
При протеинемии, гипефосфатемии, т.к. кальций в плазме связан с белком и фосфатами.
При алкалозе
При гипопаратиреозе
Сопровождается судорожным синдромом, вплоть до тетании, ларингоспазмом, до асфиксии.
ГИПЕРКАЛЬЦИЕМИЯ.
Разрушение костей из-за опухолей костей или остеомиелита
При избыточном приеме препаратов Са
При ацидозе, гипопротениемии, гиперпаратиреозе.
Возникает депрессия, артериальная гипотензия, мышечная гипотония, кальциноз сосудов и почечных канальцев.
ЛЕКЦИЯ №8: «ГИПОКСИЯ».
Гипоксия – типовой патологический процесс, характеризующийся снижением доставки кислорода к органам и тканям или нарушением его утилизации в процессах биологического окисления.
Гипоксия характеризуется снижением напряжения кислорода в артериальной крови ниже 80 мм.рт.ст. Критической величиной является напряжение кислорода 33 мм.рт.ст. для артериальной крови, 19 мм.рт.ст для венозной крови и 1.5-2 мм.рт.ст. для митохондрий. Проявлением гипоксии является тотальный или локальный энергодефицит.
Классификация гипоксии.
По течению:
Острая
Хроническая
По локализации:
Генерализованная
Локальная
Патогенетическая классификация:
Экзогенная гипоксия:
1) гипобарическая,
2) нормобарическая
Эндогенная гипоксия:
1.Респираторная
2. Циркуляторная
3. Гемическая
4. Тканевая
ЭКЗОГЕННАЯ ГИПОБАРИЧЕСКАЯ ГИПОКСИЯ.
Развивается при подъём ев горы на высоту более 3,5 тысяч метров. Из-за снижения барометрического давления в воздухе снижается парциальное давление О2, что приводит к снижению кислорода в артериальной крови и развитию гипоксемии. В ответ на это активируются хеморецепторы, сигнал поступает в дыхательный центр и возникает гипервентиляция лёгких. При этом снижается Ра СО2 в артериальной крови, наступает гипокапния, развивается респираторный алкалоз. При алкалозе сродство Нв к О2 повышается, что делает связь между ними более прочной, кривая диссоциации и оксигемоглобина смещается влево, что приводит к затруднению отдачи О2 тканям и ещё больше усугубляет гипоксическое состояние. Через некоторое время происходит активация гликолиза, накапливается молочная кислота и респираторный алкалоз сменяется метаболическим ацидозом.
ЭКЗОГЕННАЯ НОРМОБАРИЧЕСКАЯ ГИПОКСИЯ.
Возникает при длительном пребывании людей в герметически замкнутых помещениях (в шахтах, под завалами, в бомбоубежищах). При этом в процессе дыхания люди поглощают О2, выделяют СО2 и в конечном итоге во вдыхаемом воздухе содержится мало О2 и много СО2, что приводит к снижению Ра О2 в артериальной крови(гипоксемия) и повышение давления СО2 (гиперкапния), развивается респираторный ацидоз, кривая диссоциации и оксигемоглобина смещена вправо, т.к сродство Нв к О2 снижается, что затрудняет насыщение Нв кислородом в лёгких. В дальнейшем активируется гликолиз и респираторный ацидоз усугубляется метаболическим.
ЭНДОГЕННЫЕ ГИПОКСИИ.
Респираторная гипоксия возникает при нарушении процесса внешнего дыхания (альвеолярной вентиляции, диффузии газов легких, перфузии крови по сосудам лёгких). При этом из-за нарушения работы органов дыхания нарушается поступление О2 и выведение СО2. Возникает гипоксемия и гиперкапния, развивается респираторный ацидоз, сродство Нв к О2 снижается, кривая диссоциации оксигемоглобина смещается вправо, что ещё более затрудняет насыщение Нв кислородом в лёгких. В дальнейшем активируется гликолиз и развивается метаболический ацидоз.
Циркуляторная гипоксия. Возникает при патологии ССС, это единственная форма гипоксии, которая может быть как генерализованной, так и локальной. Генерализованная развивается при всех видах шока, при сердечной недостаточности. Локальная – при ишемии, венозной гиперемии и нарушениях микроциркуляции. Основным звеном патогенеза циркуляторной гипоксии является резкое замедление кровотока, в результате чего ткани не получают достаточного количества О2, не выводится СО2, на уровне тканей возникает ацидоз из-за накопления СО2 и молочной кислоты, кривая диссоциации оксигемоглобина сдвигается вправо только на уровне тканей, что облегчает отдачу О2 гемоглобинном и из крови утилизируется больше О2, чем в норме (в норме около 30%). Из – за этого напряжение О2 в венозной крови снижается, а артериовенозная разница в напряжении кислорода возрастает.
ГЕМИЧЕСКАЯ ГИПОКСИЯ.
Развивается в результате уменьшения кислородной емкости крови.
Бывает 2х форм:
1.Анемическая – возникает при всех формах анемии из-за уменьшения эритроцитов и общего внутриэритроцитарного Нв.
2. Вследствие инактивации Нв. Выделяют 2 формы инактивированного Нв:
1) – карбоксигемоглобин, образуется при отравлении угарным газом (СО).
2) – метгемоглобин содержит трехвалентное железо и образуется под действием метгемоглобинобразователей.
Метгемоглобин и карбоксигемоглобин не способны связывать О2. Они также влияют на оставшийся неинактивированным гемоглобин увеличивая его сродство к О2. Из – за чего связь неинактивированного гемоглобина с О2 становится более прочной и нарушается процесс отдачи кислорода тканям, поэтому при одинаковой степени уменьшения кислородной ёмкости крови анемическая форма гемической гипоксии протекает легче, чем форма вызванная инактивацией гемоглобина.
Метгемоглобин образуется под действием метгемоглобино образователей, к которым относятся нитраты, нитриты, окислители (перманганат калия), красители (метиленовая синь), лекарственные препараты(сульфаниламиды, противотуберкулезные средства).
ТКАНЕВАЯ ГИПОКСИЯ.
Возникает в результате нарушения утилизации О2 тканями. Причины:
1.Инактивация ферментов дыхательной цепи: цианидами может инактивироваться цитохромоксидаза, эфиром, алкоголем, барбитуратами инактивируется дегидрогеназы.
2.Нарушение синтеза дыхательных ферментов возникает при дефиците их коферментов, которыми являются витамины группы В.
3.Разобщение окисления и фосфорилирования возникает при отравлении динитрофенолом при гипертиреозе из-за утечки протонов водорода из трансмембранного пространства митохондрий и нарушения работы ферментов АТФ- синтетазы.
1 и 2 формы гипоксии характеризуются нарушением утилизации О2 тканями, из-за чего напряжение О2 в венозной крови увеличивается, а артериовенозная разница в напряжёнии О2 уменьшается. Разобщение окисления и фосфорилирования гипоксией можно назвать условно, поскольку ни доставка, ни утилизация О2 не нарушается, но энергодифицит возникает такой же, как при гипоксии
НАРУШЕНИЯ В ОРГАНИЗМЕ ПРИ ГИПОКСИИ.
Зависят от того, генерализованная или местная гипоксия, острая или хроническая. При острой гипоксии развивается гипоксический некроз, а при хронической гипоксии возникает атрофия тканей. Чувствительность клеток к гипоксии зависит от:
1. Интенсивности обмена веществ,
2. Интенсивности гликолиза,
3. Способности генетического аппарата к перестройке.
4. Запасов макроэргов в клетке
Самыми чувствительными к гипоксии являются клетки коры больших полушарий, которые погибают при полном прекращении поступления О2 через 8 минут. Подкорковые структуры погибают при прекращении поступления О2 через 15 минут. Миокард через 30 минут. Почки и печень через 1 час, скелетная мускулатура через 1,5 часа. Поэтому при генерализованной гипоксии нарушения в организме связаны с патологией вышеперечисленных органов. Так при острой гипоксии в первую очередь страдает ЦНС, что сначала сопровождается возбуждением, затем угнетением, потерей сознания, развитием комы, кроме того развивается сердечная недостаточность, печёночная и почечная недостаточность. (полиорганная недостаточность)
При хронической гипоксии будет развиваться гипоксическая энцефалопатия, возможно развитие хронической формы СН, хронической почечной и печеночной недостаточности.
Острая локальная гипоксия проявляется –инфарктами, инсультами. Хроническая – локализация гипоксия приводит к атрофии органов или тканей.
ЗАЩИТНЫЕ РЕАКЦИИ ПРИ ГИПОКСИИ. Адаптация организма к гипоксии.
ЗАЩИТНЫЕ РЕАКЦИИ ПРИ ОСТРОЙ ГИПОКСИИ – реализуются за счет краткосрочных защитных реакций, которые проявляются гиперфункцией органов и систем, осуществляющих доставку О2 и его утилизацию. Все начинается с активации стресс-реакции, в результате чего активируется сисмпато адриналовая и гипоталамо- гипофизарнонадпочечниковая система, происходит выброс катехоламинов, что приводит к гипервентиляции легких, увеличению силы и частоты сердечных сокращений, возникает централизация кровообращения в результате которой спазмируются периферические сосуды и расширяются сосуды сердца и головного мозга, а также возникает выброс депонированной крови из трабекул печени и селезёнки, в результате их спазма, что увеличивает кислородную ёмкость крови. Кроме того под действием катехоламинов и глюкокортикоидов усиливается активность ферментов дыхательной цепи и сопряжение окисления с фосфорилированием.
ЗАЩИТНЫЕ РЕАКЦИИ ПРИ ХРОНИЧЕСКОЙ ГИПОКСИИ осуществляются за счёт долговременных защитных механизмов, в основе которых лежит активация генетического аппарата клетки и развитие гипертрофии и гиперплазии органов, участвующих в адаптации к гипоксии. Происходит гипертрофия миокарда, в жизненно важных органах прорастают дополнительные сосуды, происходит гиперплазия альвеол, что увеличивает жизненную емкость легких, в почках секретируется эритропоэтин, под действием которого в красном костном мозге активируется эритропоэз, развивается реактивный эритроцитоз. В транях образуются дополнительные митохондрии и дыхательные ферменты.
Лекция №9.
ТЕМА: «НАРУШЕНИЕ ПЕРЕФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ И МИКРОЦИРКУЛЯЦИИ».
Периферическое кровообращение – это перфузия крови по сосудам микроциркуляторного русла.
К сосудам МЦР относятся:
1. Артериолы;
2. Метартериолы;
3. Капилляры;
4. Венулы;
5. Артериовенозные шунты
Микроциркуляция – совокупность процессов:
1. Перфузии крови по сосудам МЦР;
2. Обмена между кровью и интерстициальной жидкостью;
3. Процесса образования лимфы;
Периферическое кровообращение подчиняется закону Пуазеля.
Q = ΔPπR4/8ŋl
Объемная скорость кровотока прямо пропорциональна градиенту давления на артериальном и венозном концах капилляра и радиусу сосуда в 4 степени, а обратно пропорциональна вязкости крови и длине сосуда.
Q –объемная скорость кровотока
ΔP – градиент давления на артериальном и венозном конце капилляра
Π – константа
R4 – радиус в 4 степени
Ŋ – вязкость крови
L – длина сосуда
Все нарушения ПК связаны с изменениями радиуса сосудистой стенки, а нарушения микроциркуляции сопровождаются нарушением вязкости крови.
Обмен между кровью и интерстициальной жидкостью протекает по двум механизмам:
1 – диффузия – это вид пассивного транспорта через полупроницаемые мембраны по градиенту концентрации растворенных веществ.
2- фильтрация – (реабсорбция) вид пассивного транспорта через полупроницаемые мембраны по градиенту давления. Фильтрация определяется по закону Старлинга.
V = kЧЭФД
V- фильтрация (реабсорбция)
K – кофициент фильтрации (зависит от проницаемости сосудистой стенки)
ЭФД – эффективное фильтрационное давление
ЭФД= (Гкр+ Отк) – (Окр+ Гтк)
Гкр – гидростатическое давление крови
Отк – онкотическое давление ткани (интерстициальной жидкости)
Окр- онкотическое давление крови
Гтк- гидростатическое давление ткани (интерстициальной жидкости)
На артериальном конце капилляра гидростатическое давление крови примерно равно 32,5 мм.рт.ст. Онкотическое давление ткани – 4,5 мм.рт.ст., онкотическое давление крови – 25 мм.рт.ст. и гидростатическое давление ткани 3 мм.рт.ст.
ЭФД= (32,5 + 4,5) – (25+3)= 9 мм.рт.ст.
Если ЭФД направлено из крови в ткань идет процесс фильтрации.
На венозном конце капилляра гидростатическое давление крови снижается до 17,5 мм.рт.ст. Онкотическое давление ткани – 4,5 мм.рт.ст., онкотическое давление крови – 25 мм.рт.ст. и гидростатическое давление ткани 3 мм.рт.ст.
ЭФД= (17,5 + 4,5) – (25+3)= -6 мм.рт.ст.
Минус показывает на то, что направление ЭФД изменилось, и жидкость поступает из ткани обратно в кровь, т.е. идёт процесс реабсорбции. Фильтрационное давление составляет 9 мм.рт.ст, а реабсорбционное 6 мм.рт.ст., поэтому не вся профильтровавшаяся жидкость возвращается обратно в сосуд, часть жидкости не подвергается реабсорбции и идёт на образование лимфы.
НАРУШЕНИЕ ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ.
Связаны с изменением радиуса сосудистой стенки. Согласно классификации к нарушениям периферического кровообращения относятся:
1. Артериальная гиперемия
2. Венозная гиперемия
3. Ишемия
4. Тромбоз
5. Эмболия
6. Стаз
Истинными нарушениями периферического кровообращения можно считать венозную гиперемию и ишемию. Артериальная гиперемия в большинстве случаев является не нарушением, а защитной реакцией, тромбоз и эмболия являются причинами изменения радиуса сосудистой стенки и приводят к развитию ишемии и венозной гиперемии, а стаз является следствием нарушения периферического кровообращения.
Артериальная гиперемия.
Это увеличение кровенаполнения органа или ткани из-за повышенного притока крови, вследствие увеличения радиуса артериол. Артериальная гиперемия бывает:
1. Физиологическая, т.е защитная реакция на недостаточное кровоснабжение. При этом выделяют рабочую артериальную гиперемию, которая возникает при усиленной функциональной нагрузке на орган или ткань, а также реактивная, которая возникает после ишемии.
2. Патологическая – бывает в результате нарушения нервной регуляции сосудистого тонуса и при действии медиаторов воспаления.
МЕХАНИЗМЫ, ЛЕЖАЩИЕ В ОСНОВЕ АРТЕРИАЛЬНОЙ ГИПЕРЕМИИ.
1. Местный метаболический – лежит в основе физиологической формы артериальной гиперемии. Заключается в том, что в интенсивно работающем органе или органе, испытывающем гипоксию, накапливаются метаболиты (кислые продукты обмена:молочная кислота, СО2, протоны водорода), вызывающие расширение сосудистой стенки и развитие артериальной гиперемии.
2. Нейрогенный лежит в основе патологической формы артериальной гиперемии. В норме сосудистый тонус поддерживается симпатической нервной системой, за счёт влияния на альфа- адренорецепторы сосудов. При повреждении симпатических центров, симпатических нервов, симпатических ганглиев, а так же при приёме симпатоблокаторов, ганглиоблокаторов происходит расширение периферических сосудов и развивается артериальная гиперемия.
3. Медиаторный – сосуды расширяются под действием медиаторов воспаления (гистамин, брадикинин, простагландины)
МЕСТНЫЕ ПРИЗНАКИ АРТЕРИАЛЬНОЙ ГИПЕРЕМИИ.
Увеличение объёма, увеличение тургора органа или ткани, покраснения, увеличение местной температуры, возможен отёк.
ВЕНОЗНАЯ ГИПЕРЕМИЯ.
Это увеличение кровенаполнения органа или ткани, вследствие нарушения оттока крови из-за уменьшения радиуса вен или венул.
Причины:
1. Обструкция вены (закупорка изнутри) тромбом или эмболом
2. Компрессия или сдавление вены извне отёком, опухолью, жгутом.
3. Нарушение клапанного аппарата вен
Последствиями венозной гиперемии является отёк, гипоксия, инфаркт (гипоксический некроз) при остром состоянии, а при хроническом – гипоксическая атрофия ткани.
МЕСТНЫЕ ПРИЗНАКИ: цианоз, увеличение тургора или объёма, уменьшение местной температуры, отёк.
ИШЕМИЯ – Это недостаточное кровенаполнение органа или ткани, вследствие уменьшения притока крови из-за сужения артериол. Ишемия может возникнуть при несоответствии между потребностью органа в кровоснабжении и способностью эту потребность удовлетворять за счет расширения соссудов.
Причины:
1. Увеличение ригидности сосудистой стенки, вследствие атеросклероза;
2. Обструкция артерий или артериол тромбом или эмболом
3.Компрессия – сдавление отёком, жгутом, опухолью
4. Спазм сосуда
5. Разрыв сосуда
При ишемии развивается гипоксия, приводящая к некрозу или атрофия ткани.
Местные признаки: бледность, уменьшение тургора и объёма органа, снижение местной температуры, боль из-за выделения медиаторов боли и парастезии (онемения, покалывания)
ТРОМБОЗ - Это процесс прижизненного свёртывания крови в сосудах, направленный на остановку кровотечения, вследствие повреждения сосудистой стенки. Тромбоз является физиологическим процессом и защищает от кровопотери, однако образующиеся тромбы могут уменьшать просвет сосуда и приводить к развитию ишемии (артериальные тромбы) и венозной гиперемии (венозные тромбы). Кроме того тромбы могут отрываться и вызывать эмболию.
Причины тромбоза согласно триаде Вирхова:
1. Повреждение эндотелия сосудов
2. Замедление кровотока
3. Нарушения в свертывающей и противосвертывающей системах крови.
Тромбоз не всегда является физиологическим процессом, иногда наблюдаются патологическое тромбообразование. Патологические тромбообразование возникает, если нет нарушения целостности сосудистой стенки и кровотечения.
Причины:
1. Повреждения эндотелия без нарушения целостности сосудистой стенки (вирусы геморрагических лихорадок, атеросклероз, бактерии, токсины)
2. Попадание в кровоток активных протеолитических ферментов (при остром панкреатите, укусах змей, пчел), либо при активации собственных протеазных систем крови (каллекриин-кининовой, свертывающей, фибринолиза и комплемента).
3. Попадание в кровоток большого количества фосфолипидов из разрушенных тканей (тканевой тромбопластин) при некрозах, травмах, ожогах, гемолизе.
4. Выделение в системный кровоток высоких концентраций ФНО-α (при сепсисе, опухоли)
Исходы тромбоза:
Лизис тромба (полное разрушение)
Организация и реканализация тромба (прорастание соеденительной тканью с последующим образованием в ней сосудистых каналов)
Петрификация тромба – отложение в нем солей Са.
Септическое расплавление- неблагоприятный исход тромбоза сопровождающийся инфицированием и гнойным расплавлением.
ЭМБОЛИЯ – Это перенос с током крови субстратов (эмболов), в норме в ней не присутствующих.
Бывает:
1) Экзогенная: газовая (при ранении шейных вен), жировая (при введении масляных растворов), инородными телами (катетеры, осколки).
2) Эндогенная: тромбоэмболия (80%), газовая (при кессонной болезни), жировая (при переломе трубчатых костей), околоплодными водами, паразитарная.
По локализации:
1. Большого круга кровообращения
2. Малого круга кровообращения
3. Воротной вены
По распространению:
1. Прямая (эмбол движется по току крови)
2. Ретроградная (эмбол движется против тока крови под силой тяжести)
3. Ортодоксальная (эмбол проникает через овальное окно или дефекты межпредсердной или межжелудочковой перегородок)
Последствия эмболии: ишемия, венозная гиперемия.
СТАЗ – Это остановка крови в сосудах микроциркуляторного русла.
1. Ишемический стаз (развивается при ишемии)
2. Венозный стаз (при венозной гиперемии)
3. Истинный (капиллярный) стаз не является нарушением периферического кровообращения, а относится к нарушениям микроциркуляции.
НАРУШЕНИЕ МИКРОЦИРКУЛЯЦИИ.
Возникают при нарушении реологических свойств крови – вязкости.
Выделяют три механизма развития нарушений микроциркуляции.
1. Внутрисосудистые
2. Внесосудистые
3. Вследствие повышения проницаемости сосудистой стенки.
При внутрисосудистых нарушениях микроциркуляции начальным звеном патогенеза является повышение вязкости крови, что может возникать при дегидратации, увеличения содержания в крови агрегантов (тромбоксан, фактор активации тромбоцитов, АДФ), при потере отрицательного заряда мембран клетками крови, вследствие их покрытия белками опсонинами, при увеличении белка в крови (особенно, белков острой фазы) при этом образуются конгломераты из клеток, получивших название сладжей, которые замедляют кровоток и приводят к стазу.
Повышение проницаемости сосудистой стенки может возникать:
При повреждении сосудистой стенки бактериями, вирусами, токсинами.
При действии медиаторов воспаления.
При этом увеличивается кофициент фильтрации, в интерстициальное пространство выходит не только жидкость и электролиты, но и белки плазмы, в результате образуется экссудативный или воспалительный отёк.
Внесосудистые нарушения микроциркуляции связаны:
С повреждением околососудистой ткани за счёт чего увеличивается содержание белка в интерстициальной жидкости, повышается онкотическое давление ткани, что приводит к скоплению жидкости и формированию отёка, который сдавливает сосуды и способствует возникновению стаза.
При нарушении лимфооттока также образуются отёки. Нарушение лимфооттока может быть при сдавлении лимфатических сосудов отеком, жгутом, опухолью, при их закупорке тромбом или эмболом, при нарушении клапанного аппарата лимфатических сосудов.
ОТЁКИ.
Отёки могут возникать:
Гемодинамические:
При высоком гидростатическом давлении крови на артериальном конце капилляра (артериальные гипертензии, гипертоническая болезнь, артериальная гиперемия).
При высоком гидростатическом давлении крови на венозном конце - возникает при венозной гиперемии, при застое крови, при сердечной недостаточности.
образуется транссудат
Онкотические:
При снижение онкотического давления крови, что возникает при уменьшении белков в плазме крови (при печеночной недостаточности, при нефротическом синдроме, при голодании белковом). При снижении онкотического давления крови снижается реабсорбция и образуется транссудат.
Воспалительные:
Увеличении кофициента фильтрации возникает при увеличении проницаемости сосудистой стенки, усиливается фильтрация не только жидкости, но и белков. Появляется экссудат.
При повышении онкотического давления ткани происходит задержка жидкости в интерстициальном пространстве, что приводит к формированию экссудата.
Лимфотические:
При нарушении лимфооттока, что сопровождается повышением гидростатического давления интерстициальной жидкости.
ВОСПАЛЕНИЕ.
ВОСПАЛЕНИЕ – типовой патологический процесс, в основе которого лежит комплексная, местная, сосудистая, тканевая, защитно- приспособительная реакция целостного организма в ответ на действие повреждающего фактора. Воспаление является стандартным, эволюционно выработанным ответом, возникающим на уровне ткани в ответ на любое повреждение.
Причины воспаления:
I. Экзогенные
Физические (механическое повреждение, радиация, термическое повреждение)
Химические (кислоты, щелочи, окислители)
Биологические (бактерии, вирусы, грибы, простейшие)
II. Эндогенные
Некроз любого генеза
Опухоль
Камни
аутоиммунные реакции
Бывает острым и хроническим.
Острое воспаление – это эволюционно сформировавшийся процесс, возникающий в ответ на попадание внеклеточных пиогенных бактерий, либо на очаг некроза. Характеризуется развитием в течение нескольких часов, длится несколько дней – недель, имеет стандартную картину течения, мало зависящую от причин и локализации процесса.
Хроническое – эволюционно сформировавшийся ответ организма на попадание внутриклеточных бактерий, грибов, простейших и персистирующих вирусов. Развивается в течение нескольких дней, длится месяцы – годы. Характеризуется выраженной пролиферацией с образованием инфильтратов, которые приобретают вид гранулём. Имеет различную картину течения, сильно зависящую от причины и локализации процесса.
Биологическая роль острого воспаления – ограничение возбудителя или очага некроза от организма, уничтожение возбудителя, элиминация его из организма, с последующим восстановлением (репарацией) очага повреждения.
Биологическая роль хронического - ограничение возбудителя от организма для предотвращения его распространения.
Стадии воспаления (их лучше называть процессами)
1 стадия – альтерация (повреждение)
2 стадия – экссудация
3 стадия – пролиферация.
Альтерация бывает первичной и вторичной. Первичная альтерация возникает под действием повреждающего фактора.
Вторичная возникает в результате выделения медиаторов воспаления, которые могут непосредственно повреждать ткани (свободные радикалы, протеолитические ферменты, катионные белки), но в основном вторичная альтерация развивается в результате того, что медиаторы воспаления вызывают нарушения микроциркуляции, что приводит к гипоксии в очаге воспаления и некрозу, т. е вторичная альтерация проявляется гипоксическим повреждением.
Экссудация – выход жидкости из сосудов в интерстициальное пространство из-за увеличенной проницаемости сосудистой стенки и формирования воспалительного отёка (экссудата). Особенностью экссудата является то, что помимо жидкости происходит выход белков плазмы, а в последствии и клеток – лейкоцитов.
Пролиферация – размножение клеток в очаге воспаления. Может быть пролиферация макрофагов с целью уничтожения возбудителя или ограничения от организма и может быть пролиферация клеток паренхимы и соединительной ткани, с целью восстановления после повреждения - репарация.
В развитии воспаления выделяют 2 звена:
1) Сосудистое
2) Клеточное
Их возникновение обусловлено действием медиаторов воспаления.
Медиаторы воспаления – это биологически активные вещества, образующиеся клетками в очаге воспаления, запускающие сосудистые и клеточные реакции.
Классификация медиаторов.
1. Внутриклеточные медиаторы:
Накопленные
Вновьсинтезированные
2. Плазменные
ВНУТРИКЛЕТОЧНЫЕ НАКОПЛЕННЫЕ МЕДИАТОРЫ:
К ним относятся гистамин, серотонин, катионные белки и лизосомальные ферменты. Гистамин и серотонин – это биогенные амины, которые выделяются сразу же в ответ на повреждение, катионные белки и протеолитические ферменты содержатся в гранулах фагоцитов и появляются в очаге воспаления только вместе с клетками их содержащими (макрофаги, нейтрофилы).
Гистамин выделяется тучными клетками и базофилами крови в ответ на:
1. Выработку Ig E
2. Действие анафилотоксинов
3. Механическое, термическое, химическое повреждение
4. Действие интерлейкина 1
Гистамин расширяет сосуды и увеличивает их проницаемость, может вызывать бронхоспазм.
Серотонин выделяется из тромбоцитов при их активации, которая происходит под действием агрегантов: простагландина А (тромбоксана), фактора активации тромбоцитов, АДФ. Серотонин вызывает спазм сосудов и увеличение их проницаемости.
Катионные белки – это неферментативная группа белков, содержащихся в гранулах фагоцитов
(нейтрофилов, макрофагов, эозинофилов), которые выделяются в процессе фагоцитоза, прикрепляются к бактериальной стенке меняя её заряд, повышая её проницаемость и вызывая лизис, кроме того они могут повреждать собственные ткани в очаге воспаления и сосуды, повышая проницаемость сосудистой стенки.
Протеолитические ферменты бывают 2 типов:
1. Нейтральные протеазы (коллагеназа и эластаза) выделяются фагоцитами в процессе прохождения через базальную мембрану сосудов, повышают проницаемость сосудистой стенки.
2. Кислые протеазы являются содержимым гранул лизосом, используются для переваривания фагоцитируемых микроорганизмов.
Внутриклеточные вновьсинтезируемые медиаторы:
1. Простагландины и лейкотриены (экозоноиды) являются производными арахидоновой кислоты, которая входит в состав фосфолипидов клеточных мембран. Арахидоновая кислота отщепляется от мембраны под действием фермента – фосфолипазы А2. Фосфолипаза А2 содержится практически во всех клетках и активируется при поступлении в клетку Са2+. Причиной его поступления является увеличение проницаемости мембран любой этиологии (механическое повреждение, гипоксия, свободно – радикальное повреждение, а также действие медиаторов воспаления на клеточные рецепторы). В клетке на арахидоновую кислоту действуют два фермента, циклооксигеназа, под действием которой синтезируются простагландины и липооксигеназа, под действием которой синтезируются лейкотриены.
Первым образуется простаглондин G2, который превращается в ПГН2 из которого синтезируются основные простагландины.
ПГА2-тромбоксан – выделяется поврежденным эндотелием (в области повреждения сосудистой стенки) вызывает спазм сосуда и повышает агрегацию тромбоцитов, является компонентом свертывающей системы крови.
ПГ I2 – простоциклин – выделяется неповрежденным эндотелием, расширяет сосуды, снижает агрегацию тромбоцитов, является компонентом противосвертывающей системы.
ПГ Е1,Е2,D2,F2a – образуются в очаге воспаления, расширяют сосуды и повышают их проницаемость.
Под действием липооксигеназы из арахидоновой кислоты сначала образуется лейкотриен А4 из него синтезируются ЛТВ4 (который участвует в процессах хемотаксиса и является хемоатрактантом) и ЛТ С4,Е4,D4 – которые вызывают спазм сосудов, спазм бронхов и повышают проницаемость сосудов.
СХЕМА-ВСТАВИТЬ!
2. Цитокины (это полипептиды, образующиеся в ходе воспаления и иммунного ответа и, регулирующие все стадии воспаления и иммунитета. К медиаторам воспаления относят только некоторые из них, цитокины обладающие системным типом действия. Это ИЛ1,ИЛ6, ФНО-а. Данные цитокины выделяются преимущественно макрофагами в процессе фагоцитоза и оказывают местные и общие реакции при воспалении.
К местным эффектам относят
1. Синтез молекул клеточной адгезии
2. Активация тромбопластина и повышение свертываемости крови
3. Вызывают хемотаксис лимфоцитов
4. Активируют процессы пролиферации в очаге воспаления
5. Расширяют сосуды и повышают их проницаемость.
К общим эффектам цитокинов относят системный ответ организма на воспаление или реакции острой фазы:
1. Лихорадка
2. Анорексия
3. Сонливость
4. Синтез белков острой фазы
5. Нейтрофильный лейкоцитоз
6. Активация стресс-реализующей системы
7. Активация стресс-лимитирующей системы
3. Фактор активации тромбоцитов (ФАТ) – образуется эндотелием и фагоцитами, выделяющимися в области повреждения сосудистой стенки, вызывают активацию тромбоцитов, их агрегацию, вызывают спазм сосудов и повышение их проницаемости. Увеличивают выработку тромбопластина и запускает продукцию других медиаторов воспаления.
4. Свободные радикалы – образуются макрофагами и нейтрофилами в процессе фагоцитоза, необходимы для внутриклеточного уничтожения фагоцитированных бактерий, а также оказывают повреждающее действие на ткани в очаге воспаления, повреждают сосудистую стенку, повышают ее проницаемость.
5. Эндотелий релаксирующий фактор – оксид азота – выделяется эндотелием, является компонентом противосвёртывающей системы, расширяет сосуды, уменьшает агрегацию тромбоцитов, при взаимодействии с другими радикалами становится мощным радикалом и обладает всеми свойствами сваободных радикалов.
ПЛАЗМЕННЫЕ МЕДИАТОРЫ воспаления образуются в результате активации 4-ёх протеазных систем крови (каллекриин - кининовой, свёртывающей, фибринолиза, комплимента). Особенностью протеазных систем крови является то, что они представлены неактивными протеолитическими ферментами, синтезируемыми печенью и клетками крови и активируются они по типу каскадного протеолиза. Одновременно при активации одной из систем происходит активация всех остальных. У каждой системы есть отдельные пути активации, свои собственные, и есть общие пути активации.
Свертывающая система и система фибринолиза относятся к системе гемостаза. Система комплемента участвует в гуморальном неспецифическом иммунитете и каллекриин-кининовая система относится к воспалению. Общий путь активации этих систем осуществляется через XII фактор свертывания (фактор хагемана). Фактор хагемана является наиболее легко активируемой протеазой из свертывающей системы. Он может быть активирован при контакте с любой положительно заряженной поверхностью (коллаген базальной мембраны сосуда в области повреждения сосудистой стенки, тромбопластин), при воздействии любого протеолитического фермента (острый панкриатит, укусы змей, пчел), при избытке катехоламинов и т.д. При активации фактора хагемана одновременно активируется свертывающая система и система каллекриин- кининовая. При активации каллекриин-кининовой системы прекаллекриин превращается в каллекриин, который является сильным протеолитическим ферментом и расщепляет кининоген с образованием брадикинина. Брадикинин является плазменным медиатором,который расширяет сосуды и повышает их проницаемость. При активации свертывающей системы образуется фибрин, который под действием плазмина из системы фибринолиза распадается на продукты деградации фибрина, ПДФ являются плазменными медиаторами воспаления и расширяют сосуды, повышают их проницаемость. Система комплемента может активироваться своими собственными путями. Классическим – комплексом антиген-антитело и альтернативным – липополисахаридами бактериальной стенки. Но в общем пути активации система комплемента может быть активирована каллекриином и плазмином. В процессе активации системы комплемента образуется фермент С3 конвертаза, которая расщепляет С3 белок на С3а и С3в компоненты системы комплемента. С3в компонент расщепляет С5 на С5а м С5в. С5в прикрепляется к бактериальной стенке и к нему последовательно соединяются 6,7,8,9 компоненты комплемента. При этом образуется мембранатакующий комплекс С5в6789, который встраивается в бактериальную стенку, образуя в ней ионный канал и вызывая лизис. Это иммунная роль системы комплемента. А С3а и С5а компоненты комплемента являются плазменными медиаторами воспаления. Они получили название анафилотоксинов, являются хемоатрактантами и вызывают дегрануляцию тучных клеток, способствуя выделению гистамина, который расширяет сосуды и повышает их проницаемость. Также медиатором воспаления можно назвать С3в компонент, который является опсонином и участвует в фагоцитозе.
СХЕМА- ВСТАВИТЬ!
СОСУДИСТЫЕ РЕАКЦИИ ПРИ ВОСПАЛЕНИИ.
1. Кратковременный спазм сосудов возникает только при механическом, термическом, химическом повреждении, затрагивающем кожные покровы и подлежашие ткани; возникает рефлекторно, а также в результате выделения серотонина или тромбоксана, в случае повреждения сосудов. При попадании бактерий в организм спазм не возникает.
2. Расширение сосудов возникает в результате выделения медиаторов воспаления. Таких, как гистамин, простагландины, брадикинин, приводит к развитию артериальной гиперемии в области повреждения.
3. Повышение проницаемости сосудистой стенки возникает под действием всех медиаторов воспаления, может быть за счёт спазма эндотелиоцитов под действием гистамина, серотонина, простагландинов, брадикинина или из-за непосредственного повреждения эндотелиоцитов и базальной мембраны сосудов под действием свободных радикалов, протеолитических ферментов и катионных белков. Из-за увеличения проницаемости сосудистой стенки происходит выход жидкости и белка из сосудов, что приводит к образованию экссудата и формированию воспалительного отёка, который сдавливает сосуды и способствует венозной гиперемии, а так-жена ряду с клеточными реакциями способствует ограничению очага воспаления. Т.е. по периферии очага воспаления наблюдается артериальная гиперемия, а в центре возникают нарушения микроциркуляции, наблюдается стаз и развивается гипоксическое повреждение.
Лекция № КЛЕТОЧНЫЕ РЕАКЦИИ ПРИ ВОСПАЛЕНИИ.
К клеточным реакциям относятся:
1. Маргинация и Ролинг
2. Адгезия
3. Эмиграция
4. Фагоцитоз
Маргинация - это выпадение лейкоцитов из осевого кровотока и медленное движение их вдоль эндотелия сосудистой стенки. Является пассивным процессом и возникает из-за резкого замедления кровотока в очаге воспаления. Ролинг – перекатывание лейкоцитов вдоль эндотелия.
Адгезия - это взаимодействие лейкоцита с эндотелием с помощью специальных комплиментарных молекул, получивших название молекул клеточной адгезии. На лейкоцитах находится лейкоцитарный фактор адгезии (ЛФА – 1), экспрессия которого на поверхность лейкоцитов происходит под действием С5 А компонента комплемента. На эндотелии находятся следующие рецепторы: ЭЛАМ – 1 (эндотелиально-лейкоцитарная адгезивная молекула) – интегрин, МАК – 1 (молекула адгезии клеток)– селектин. Взаимодействие между этими рецепторами приводит к тому, что лейкоцит прикрепляется к поверхности эндотелия.
Эмиграция - при взаимодействии лейкоцита с эндотелием на поверхности лейкоцита начинает образовываться выпячивание или псевдоподия, которая проникает в межэндотелиальный промежуток, а дальше лейкоцит с помощью псевдоподии просачивается под эндотелий и распластывается на базальной мембране сосуда, после чего лейкоцит выделяет нейтральные протеазы (коллагеназу и эластазу), которые образуют отверстия в базальной мембране, ч/з которые лейкоцит выходит из сосуда.
ФАГОЦИТОЗ
Выделяют 4 стадии:
Хемотаксис
Узнавание и прилипание
Поглощение
Внутриклеточное уничтожение и переваривание.
Хемотаксис - это направленное движение лейкоцитов по градиенту концентрации специальных веществ – хемоатрактантов. У лейкоцитов имеются рецепторы к хемоатрактантам, и взаимодействие лейкоцита с хемоатрактантом приводит к образованию псевдоподий и движению лейкоцита к очагу воспаления. Чем выше концентрация хемоатрактантов, тем быстрее движется лейкоцит. К хемоатрактантам относятся: Продукты жизнедеятельности и распада бактерий (экзо- и эндотоксины), продукты распада собственных тканей организма, анафилотоксины (С3а и С5а компоненты комплемента), лейкотриен В4.
Узнавание и прилипание. В норме бактериальные клетки имеют отрицательный заряд мембраны, поэтому для взаимодействия с ними лейкоцитов необходимы специальные белки, которые получили название опсонинов. Опсонины прикрепляются к бактериальной стенке, лейкоциты имеют к ним рецепторы, в результате взаимодействия рецепторов лейкоцитов с белками опсонинами, происходит прилипание лейкоцита к бактериальной клетке. К опсонинам относятся: иммуноглобулин G, С- реактивный белок и С3в компонент комплимента.
Поглощение. Взаимодействие рецепторов лейкоцитов с опсонинами приводит к образованию псевдоподий, с помощью которых лейкоцит обхватывает бактериальную клетку, поглощая её, с образованием фагосомы.
Поиск по сайту: