 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Хлорирование этана

Начиная с пропана углеводороды содержат разные по природе атомы водорода.
 ,
,
продуктами могут быть

| и | 
|
1. Статистический фактор. В реакции хлорирования при высокой температуре, когда хлор-радикал очень активен и реагирует с любым атомом, с которым он сталкивается. В этих условиях образуется 75% 1-хлоропропана и 25% 2-хлоропропана.
2. Однако при низкой температуре, когда активность атакующих радикальных частиц в реакции хлорирования значительно ниже, главенствующую роль играет стабильность образующихся углеводородных радикалов. Относительная устойчивость углеводородных радикалов связана с проявляющимися электронными эффектами. Для первичного пропильного радикала смещение электронной плотности к радикальному атому и за счёт индуктивного эффекта, и засчёт эффекта сверхсопряжения меньше, чем для вторичного пропильного радикала.

Индуктивный (индукционный) эффект — смещение поделенной пары электронов s - связи, вызванное различием в электроотрицательности атомов.
Сверхсопряжение — это смещение электронов s-связи С–Н к соседнему атому углерода, имеющему негибридную р- орбиталь. Она может принимать участие в образовании p - связи, а может (как здесь, в частицах, именуемыми свободными радикалами) не принимать участия.
При низкой температуре при хлорировании пропана образуется 55% 2-хлорпропана и 45% 1-хлорпропана:

Оотносительная устойчивость насыщенных углеводородных радикалов уменьшается в ряду: третичные > вторичные > первичные. Но присутствие электроноакцепторных атомов или групп оказывает ингибирующее действие на процесс радикального галогенирования. Например, для 1-хлоробутана Cl-CH2CH2CH2CH3 вероятность замещения водорода (т.е. введения второго атома хлора в молекулу бутана) у третьего углеродного атома в 3 раза выше, чем у второго, и в 17 раз выше, чем у первого.
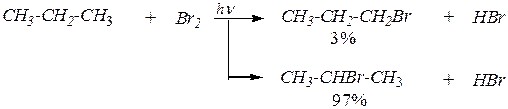
3. Доступность реакционного центра алкана для атаки реагентом.
Среди других случаев радикального замещения, характерных для насыщенных углеводородов, можно отметить реакции нитрования и сульфохлорирования.
Нитрование алканов в газовой фазе при температуре» 450°С или в жидкой фазе по М.И. Коновалову* при температуре около 150° С осуществляется разбавленной азотной кислотой (10-25%-й), содержащей диоксид азота NO2
R-H + HNO3 ® R-NO2 + H2O,
механизм реакции:
R-H + × NO2 ® R × + HNO2
HNO2 + HNO3 ® 2 × NO2 + H2O
R × + × NO2 ® R-NO2
нитроалкан
Жидкофазное нитрование достаточно селективно: из гексана при 150°С образуется 2-нитрогексан с выходом 63%.
Сульфохлорирование алканов протекает по схеме:
RH + SO2 + Cl2 ® RSO2Cl + HCl

RSO2 × + Cl2 ® RSO2Cl + Cl ×
алкансульфохлорид
Сульфохлорирование осуществляется преимущественно по первичным, наиболее доступным, атомам углеродной цепи.
Окисление алканов по связи C–H под действием атмосферного кислорода — реакция крайне медленная:
X–O–O × + RH ® R × + X–O–OH
R × + O2 ® R–O–O ×
R–O–O × + RH ® R × + R–O–OH и т.д.
Антиоксиданты добавляют в количестве от 0,001% до 3%; при этом окисление замедляется в десятки раз.
Поиск по сайту: