 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
способы получения и природные источники
При разгонке нефти получаются различные смеси алканов, которые используются в виде следующих фракций: бензин (углеводороды С5—С11), лигроин (углеводороды С8—С14), керосин (углеводороды С12—С18), дизельное топливо (углеводороды С14—С25), смазочные масла (углеводороды С20—С34), вазелин, твёрдый парафин, гудрон. Высшие фракции разгонки нефти подвергают крекингу для получения высокосортных бензинов.
Попутными нефтяными газами являются, главным образом, растворённые в нефти метан, этан, пропан, бутан и пентан примерно в равных количествах, но обычно с преобладанием метана (иногда до 50%).
Алканы могут быть получены из метана, который подвергают конверсии с водяным паром на никелевом катализаторе при температуре 700-750° С.
CH4 + H2O ® CO + 3 H2
Образующийся при этом синтез-газ в более мягких условиях (в присутствии никелевого или кобальтового катализатора при температуре 180-230° С) превращается в углеводороды и водяной пар:
n CO + (2n+1) H2 ® CnH2n+2 + n H2O
Другими синтетическими способами получения алканов являются:
Ø гидрирование непредельных углеводородов в присутствии катализатора (Ni, Pt, Pd):
СН2 = СН2 + Н2 ® СН3СН3
СН º СН + 2 Н2 ® СН3СН3
Ø восстановлением йодоводородом при нагревании производных алканов (йодалканов, спиртов):
R–I + HI ® RH + I2
R–OH + 2 HI ® RH + I2 + H2O
Ø из галогеналканов:
а) через магнийорганические соединения
R–Br + Mg ® R–MgBr
их гидролизом с сохранением углеродного скелета:
R–MgBr + H2O ® RH + Mg(OH)Br
или по реакции Вюрца*-Гриньяра * с удлинением углеродного скелета:
R–MgBr + R’–Br ® R-R’ + MgBr2
б) по реакции Вюрца
2 R–Br + 2 Na ® R–R + 2 NaBr
Ø при сплавлении солей карбоновых кислот со щелочами в лабораторных условиях при 200-300°С можно получить метан:
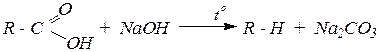 ,
,
и другие низшие алканы;
Ø гидролиз карбида алюминия ¾ удобный способ получения метана в лаборатории:
Al4C3 + H2O ® CH4 + Al(OH)3
Ø электролиз натриевых и калиевых солей монокарбоновых кислот по Кольбе* ¾ способ получения алканов с чётным числом атомов углерода в молекуле:
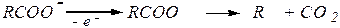
R × + × R ® R–R;
Ø из альдегидов и кетонов по реакции Кижнера*-Вольфа *:

Поиск по сайту: