 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Молекулярно-кинетические представления
ПОВЕРЬТЕ В СЕБЯ И ВЫ!!
Конец формы
Физика (заочники)
Раздел 2. Молекулярная физика и основы термодинамики
Тема №2. Основные представления молекулярно - кинетической теории (МКТ) газов. Физические основы термодинамики
Вопросы:
1. Основные представления МКТ-газов.
2. Физические основы термодинамики.
3. Реальные газы.
Основные представления МКТ – газов
Существует два способа описания процессов, происходящих в макроскопических телах – статистический и термодинамический.
Макроскопическим телом называется тело, состоящее из очень большого числа частиц - атомов или молекул.
В огромной совокупности молекул возникают качественно новые закономерности, называемые статистическими.
Эти закономерности утрачивают смысл при переходе к системам с малым числом частиц.
Статистическая физика изучает статистические закономерности.
Она использует вероятностные методы и истолковывает свойства тел, непосредственно наблюдаемые на опыте (давление, температура), как суммарный, усредненный результат действия отдельных молекул.
Термодинамика же изучает свойства макроскопических тел и протекающие в них процессы, не вдаваясь в микроскопическую природу тел.
В основе термодинамики лежит 3 фундаментальных закона, называемые началами термодинамики, которые были установлены в результате обобщения очень большого количества опытных фактов.
Поэтому результаты, получаемые термодинамикой, имеют весьма общий характер.
Статистическая физика и термодинамика взаимно дополняют друг друга и образуют единое целое.
Молекулярно-кинетические представления
Всякое вещество состоит из молекул.
Молекула – мельчайшая частица вещества, сохраняющая некоторые его свойства.
В состав молекул входят атомы – мельчайшие частицы химического элемента, сохраняющие его химические свойства.
Для измерения количества вещества вводится единица – моль. В одном моле любого вещества содержится одинаковое количество молекул
Na = 6,022 × 10 23 1/моль (число Авогадро).
При нормальных условиях 1 моль любого газа, занимает объем
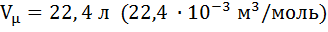 .
.
Нормальные условия:
Температура To = 273 K (0˚C).
Давление Po = 1,013 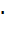 105 Па (760 мм рт. ст.)
105 Па (760 мм рт. ст.)
Все молекулы находятся в хаотическом движении, которое называется тепловым.
Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться между собой и внешней средой энергией.
Термодинамическая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом, плотностью и др.
Величины, характеризующие состояние систем называются параметрами состояния.
Соотношение, устанавливающее связь между параметрами состояния какого-либо тела, называется уравнением состояния этого тела.
В простейшем случае равновесное состояние тела определяется значениями трёх параметров:
1. Давления P, Па;
2. Объема V, м3;
3. Температуры T, K.
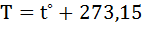
Идеальный газ – это газ, размерами его молекул пренебрегают, не учитывается взаимодействие между молекулами.
Для 1 моля идеального газа уравнение состояния
 – уравнение Клапейрона, (1)
– уравнение Клапейрона, (1)
где P – давление;
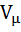 – объем 1 моля газа;
– объем 1 моля газа;
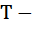 температура, К;
температура, К;
R = 8, 31 Дж / (моль 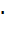 К) – универсальная газовая постоянная.
К) – универсальная газовая постоянная.
Для m, кг газа:
 – Уравнение Менделеева Клапейрона, (2)
– Уравнение Менделеева Клапейрона, (2)
где V – объём газа;
m – масса газа;
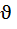 = m/ µ - число молей;
= m/ µ - число молей;
µ - молярная масса газа, кг / моль.
Пример: O2 → µ = 32 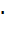 10 – 3 кг / моль.
10 – 3 кг / моль.
Н2 → µ = 2 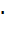 10 – 3 кг / моль.
10 – 3 кг / моль.
СO2 → µ = 44 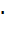 10 –3 кг / моль.
10 –3 кг / моль.
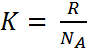
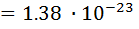 Дж / К – постоянная Больцмана.
Дж / К – постоянная Больцмана.
Из (2), можно получить другую запись уравнения Клапейрона – Менделеева (уравнения состояния):
 (3)
(3)
где 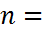
 – число молекул в единице объема;
– число молекул в единице объема;
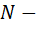 число молекул газа;
число молекул газа;
 объем газа.
объем газа.
При поступательном движении молекул и ударе их о стенку сосуда, давление, которое они создают
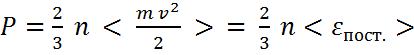 ,
,
 – средняя энергия поступательного движения молекулы.
– средняя энергия поступательного движения молекулы.
Поиск по сайту: