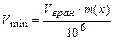|
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Систематичний і дробний хід аналізу
В якісному аналізі розповсюджена ситуація, коли одні йони заважають відкрити інші, в зв’язку з тим, що дають аналогічні реакції. Тому реакції треба комбінувати таким чином, щоб до того часу, коли приступають до відкриття будь-якого йона, всі йони, які заважають були відкриті і усунені попередніми операціями.
Така послідовність реакцій називається систематичним ходом якісного аналізу, він передбачає відкривання не окремо кожного катіону, а зразу цілими групами, для цього використовують групові реактиви, які осаджають всю групу катіонів.
У кислотно-лужній системі якісного аналізу катіонів групові реагенти – HCl і H2SO4 розведені, луги – KOH, NaOH, розчин аміаку NH3 ·H2O.
При аналізі аніонів – групові реагенти розчини BaCl2 і AgNO3.
Але використання групових реактивів пов’язане з довготривалими операціями - осадження, фільтрування, промивання і тощо.
Тому, дуже часто використовують дробний метод аналізу, який був введений в практику М.О. Тананаєвим, і який ґрунтується на використанні специфічних вибірково діючих реактивів і виконується в довільній послідовності в окремих порціях досліджуваного розчину.
Переваги дробного аналізу:
- більш швидкий при виконанні ніж систематичний;
- не має потреби у повному якісному дослідженні зразка;
- легко відтворюваний, можна повторити декілька разів.
Але якщо вплив заважаючих катіонів усунути не можна, використовується систематичний хід аналізу. На лабораторному практикумі якісний аналіз буде вивчатися нами поєднанням систематичного ходу аналізу розділення груп катіонів і дробного ходу аналізу катіонів в середині груп.
Основні етапи якісного аналізу:
- взяття проби і підготовка її до аналізу;
- попередні дослідження;
- одержання розчину зразка.
Способи переведення аналізованого зразка у розчин залежать від його хіміко-аналітичних властивостей, тобто це його розчинність у воді або у інших органічних та неорганічних розчинниках, термічна стійкість, кислотно-основні, окисно-відновні, електролітні властивості і т.д.
Лекція №3
Тема: Розрахунок параметрів чутливості аналітичної реакції
4. Чутливість реакцій – це найменша маса речовини, або йона, яка може бути відкрита даним реактивом.
Параметри (величини) чутливості аналітичної реакції:
а) відкриваний мінімум або абсолютна чутливість (m(х)) – це найменша маса речовини (йона), яка може бути відкрита дією даного реактиву за певних умов.
Одиниці вимірювання:
- мікрограм, мкг (1мкг=10-6г)
- нанограм, нг (1нг=10-9г)
- пікограм, пг (1пг=10-12г)
чим менший відкриваний мінімум, тим вища чутливість реакції.
б) Гранична або найменша концентрація Сгран – це відношення однієї масової частини визначуваного йона до найбільшої маси розчинника, вираженої в тих же одиницях. Оскільки розчинник вода, то масу води у грамах заміняють на кубічні сантиметри (мілілітри) г/см3, г/мл.
в) Граничне розбавлення Vгран. – величина, обернена граничній концентрації:
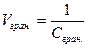 , см3/г
, см3/г
Граничне розбавлення показує, в якому найбільшому об’ємі водного розчину (в кубічних сантиметрах або мілілітрах) міститься визначуваний йон масою 1г.
Наприклад, при відкритті К+ - іона за допомогою Na3[Co(NO3)6] чутливість реакції характеризується граничною концентрацією 1:50000 г/см3, а граничне розбавлення 5000 см3/г, тобто катіон К+ масою 1г можна відкрити в 50 дм3 води (у 50 л води).
г) Мінімальний об’єм граничного розбавленого розчину Vmin – це об’єм розчину, який містить відкриваний мінімум. Цей об’єм розраховується.
Приклад. Відкриваний мінімум для К+ - іона за реакцією з Na3[Co(NO2)6] m(К+)=4 мкг. Граничне розбавлення 50000 см3/г. знайти мінімальний об’єм.
Дано: З визначення граничного розбавлення можна записати:
 m(K+)=4мкг 1г=106мкг міститься в 5·104см3
m(K+)=4мкг 1г=106мкг міститься в 5·104см3
Vгран.=50000 см3/г 4мкг- Vmin, см3
Vmin -? Vmin = 5·104·4/106=0,2 см3
Отже, загальна формула обчислення Vmin
|
д) Границя виявлення (ГВ) – це найменша маса йона у грамах, яка міститься в 1см3 досліджуваного розчину.
е) Показник чутливості (pD) – це від’ємний десятковий логарифм границі виявлення. В якісному аналізі використовують реакції з Сгран. від 1:103 до 1:5·107 г/см3, тобто ГВ=1·10-3-2·10-8г/см3
Реакція більш чутлива, чим менші m(x) і значення ГВ та більші pD і Vгран.
Приклад. Обчислити граничне Vгран. Розбавлення, границю виявлення, граничну концентрацію і показник чутливості pD, якщо NH4+ - іон масою 2,5·10-3 мкг можна виявити у розчині об’ємом 0,05 см3.
 Дано: 1) розрахуємо Vгран. з формули
Дано: 1) розрахуємо Vгран. з формули
Vmin =0,05 см3 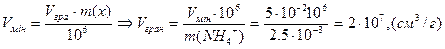
m(NH4+)=2,5·10-3 мкг 2) гранична концентрація
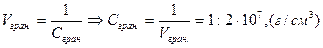
Vгран. -?, ГВ-?, 3) границя виявлення
ГВ(NH4+)=1г:2·107см3=5·10-8 г/см3
Сгран.-?, pD-? 4) pD=-lgГВ, pD(NH4+)=-lg5·10-8 =7,3
Чутливість аналітичної реакції – величина непостійна і залежить від умов проведення реакції. Умови, які впливають на чутливість аналітичної реакції:
1) достатня концентрація реактиву і аналізованої речовини у розчині;
2) наявність відповідного рН середовища;
3) дотримання температурного режиму;
4) достатній об’єм розчину аналізованої речовини;
5) послідовність додавання реактивів;
6) товщина шару розчину;
7) метод виконання реакції і спостереження результатів реакції;
8) ефект реакції;
9) присутність домішок;
10) наявність специфічного і селективного реактиву.
Способи підвищення чутливості аналітичної реакції:
1) збільшення концентрації визначуваної речовини у розчині, який аналізують, і реактиву який додають (концентрацію речовини збільшують шляхом випарювання розчину, осадження у вигляді осаду з наступним розчиненням цього осаду в невеликому об’ємі розчинника);
2) створення умов для прискорення утворення осаду (охолодження, внесення центрів кристалізації, додавання органічного розчинника);
3) зменшення розчинності осаду при додаванні органічних неелектролітів (етанолу, бензолу);
4) усунення впливу заважаючих йонів (маскування) при зв’язуванні їх у комплексні сполуки;
5) Вилучення йонів-домішок з розчину.
Поиск по сайту: