 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ГОРЕНИЕ ГАЗО- И ПАРОВОЗДУШНЫХ СМЕСЕЙ
| Расчет концентрационных пределов распространения пламени | Пример 4.1. Рассчитать КПР газа пропана С3Н8. |
Концентрационные пределы распространения пламени (область воспламенения) для газо- и паровоздушных смесей могут быть рассчитаны по следующей формуле
 , %, (4.1)
, %, (4.1)
где
j Н(В) - нижний (верхний) концентрационный предел распространения пламени (НКПР и ВКПР), %;
b - число молекул кислорода (коэффициент перед кислородом в уравнении реакции горения вещества);
a и b - константы, имеющие значения, приведенные в таблице 4.1.
Таблица 4.1. Значения коэффициентов “ а ” и “ b ” для расчета концентрационных пределов распространения пламени
| КПР | а | b |
| НКПР | 8,684 | 4,679 |
| ВКПР | ||
| b£ 7,5 | 1,550 | 0,560 |
| b> 7,5 | 0,768 | 6,554 |
1. Составляем уравнение реакции горения этанола.
С3Н8 + 5(О2 + 3,76 N2) =3СО2 + 4Н2О + 5· 3,76 N2
b = 5
2. jн = НКПР = 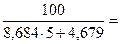 2,07 %
2,07 %
jв = ВКПР =  12,03%
12,03%
| Расчет безопасных концентрации газов и паров с использованием коэффициентов безопасности | Пример 4.2. Газоанализатор показал наличие 0,3 % паров амилацетата СН3СООС5Н11. Можно ли проводить сварочные работы? |
Значения НКПР И ВКПР следует применять при расчетах безопасных концентраций газов и паров с использованием коэффициентов безопасности:
jг.без. £  , где (4.2)
, где (4.2)
jг.без. – безопасная концентрация горючих газов, паров или пылей, % объемных;
j н – НКПР, % объемных;
Кб – коэффициент безопасности.
1. При расчете взрывобезопасных концентраций газов, паров и пылей внутри технического оборудования, трубопроводов, вентиляционных систем.
Кб = 2.
2. При расчете предельно-допустимых взрывобезопасных концентраций газов, парво, пылей в воздухе рабочей зоны с потенциальными источниками зажигания
Кб = 20.
1. Составляем уравнение реакции горения амилацетата.
СН3СООС5Н11 + 9,5(О2 + 3,76 N2) =7СО2 + 7Н2О + 9,5· 3,76 N2
b = 9,5
2. jн = НКПР =  1,14 %
1,14 %
3. Рассчитаем безопасную концентрацию:
jг.без. =  0,05 %
0,05 %
0,3 > 0,05, следовательно, проводить сварочные работы нельзя.
| Расчет стехиометрической концентрации | Пример 4.3. Рассчитать стехиометрическую концентрацию пропана С3Н8 в % объемных и г/м3 при температуре 250С и давлении 95 кПа. |
Стехиометрической концентрацией называется такая концентрация, когда реагирующие вещества взяты в эквивалентных отношениях, при этом коэффициент избытка воздуха a = 1.
Расчет стехиометрической концентрации производится по уравнению реакции горения индивидуального вещества. Общие формулы для вычисления объемной и массовой стехиометрической концентрации следующие:
jстехобъем =  , % (4.3)
, % (4.3)
jстехмасс =  , г/м3. (4.4)
, г/м3. (4.4)
1. Уравнение реакции горения пропана.
С3Н8 + 5(О2 + 3,76 N2) = 3СО2 +4Н2О + 5· 3,76 N2
b = 5
jстехобъем =  = 4,03 %
= 4,03 %
2. Молярная масса М (С3Н8) = 46 г/моль (кг/кмоль);
Vм =  = 26,1 м3/кмоль
= 26,1 м3/кмоль
jстехмасс =  = 71,0 г/м3.
= 71,0 г/м3.
| Расчет коэффициента избытка воздуха a на jн и jв | Пример 4.4. Рассчитать значение коэффициента избытка воздуха a для реакции горения пропана С3Н8 при концентрации газа, равной jн и jв. |
1. В примере 7.1. были рассчитаны значения НКПР и ВКПР для пропана.
jн = 2,07 %; jв = 12,03%.
Это означает, что в 100 м3 пропано-воздушной смеси на НКПР содержится
2,07 м3 пропана и 97,93 м3 воздуха (Vвпр); на ВКПР – 12,03 м3 пропана и 87,97 м3 воздуха.
2. Для НКПР рассчитаем теоретический объем воздуха, необходимый для сгорания 2,07 м3 пропана.
2,07 м3 х м3
С3Н8 + 5(О2 + 3,76 N2) = 3СО2 +4Н2О + 5· 3,76 N2
Vм м3 5×4,76×Vм м3
х = Vвтеор = 2,07 × 5 × 4,76 = 49,27 м3
3. Коэффициент избытка воздуха на нижнем концентрационном пределе распространения пламени составит
a =  = 1,99
= 1,99
3. Аналогично рассчитаем для ВКПР Vвтеор и соответствующее значение a:
12,03 м3 х м3
С3Н8 + 5(О2 + 3,76 N2) = 3СО2 +4Н2О + 5· 3,76 N2
Vм м3 5×4,76×Vм м3
х = Vвтеор = 12,03 × 5 × 4,76 = 286,31 м3
a =  = 0,31
= 0,31
Формула (4.1.) для расчета концентрационных пределов распространения пламени справедлива при температурах среды близкой к 200С. Как было указано выше, КПР не являются постоянной величиной и зависят от многих факторов. С повышением температуры область КПР расширяется, и, следовательно, для повышенных температур необходимо производить расчет с учетом изменения температуры.
Приближенно это можно сделать с помощью следующих формул:
jн(t) = jн ×  (4.6)
(4.6)
jв(t) = jв ×  , где (4.7)
, где (4.7)
jн, jв – концентрационные пределы распространения пламени, рассчитанные или определенные экспериментально при ~ 200С;
jн(t),jн(t) – концентрационные пределы распространения пламени при температуре Т;
1550 К, 1100 К – температура горения соответственно на НКПР и ВКПР.
| Расчет КПР при повышенных температурах | Пример 4.5. Рассчитать КПР газа пропана С3Н8 при 3000С. |
1. В примере 7.1. были рассчитаны значения НКПР и ВКПР для пропана при 200С:
jн = 2,07 %; jв = 12,03%.
2. С учетом заданной температуры КПР составят:
jн(t) = 2,07 ×  = 1,61 %
= 1,61 %
jв(t) = 12,03 ×  = 16,20 %
= 16,20 %
Для определения КПР смесей газов и паров можно воспользоваться формулой Ле Шателье:
jн(см) = 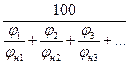 , % (4.7)
, % (4.7)
jв(см) =  , % где (4.8)
, % где (4.8)
jн(см), jн(см) – концентрационные пределы распространения пламени смеси;
jн1, jн2, jн3 - НКПР каждого компонента газовой смеси;
jв1, jв2, jв3 - ВКПР каждого компонента газовой смеси.
| Расчет КПР газовой смеси | Пример 4.6. Рассчитать КПР смеси газов следующего состава:угарный газ СО – 10 %; водород Н2 – 60 %; метан СН4 – 30 %. |
1. Определяем НКПР и ВКПР каждого горючего компонента (по справочным данным или расчетным путем):
для угарного газа jн = 12,5 %; jв = 74 %
для водорода jн = 4 %; jв = 75 %
для метана jн = 5 %; jв = 15 %
2. Определяем НКПР и ВКПР для смеси газов по формулам (4.6) и (4.7):
jн(см) =  = 4,58 %
= 4,58 %
jв(см) =  = 34 %.
= 34 %.
При взрыве газо- и паровоздушных смесей протекает кинетическое горение в замкнутом объеме. Давление, развиваемое при взрыве в этих условиях, зависит от соотношения числа молей продуктов горения, числа молей исходных веществ и температуры взрыва. Для большинства горючих веществ давление при взрыве лежит в пределах 0,6 – 1 МПа.
Наименьшее давление при взрыве развивается при концентрациях горючего вещества, равных нижнему и верхнему концентрационным пределам распространения пламени. Оно обычно не превышает 0,3 МПа. Это объясняется низкой температурой взрыва. На НКПР она равна 1550 К, на ВКПР – 1100 К. Наибольшее давление при взрыве наблюдается при концентрации, близкой к стехиометрической.
Расчет максимального давления взрыва производится по следующей формуле:
Рвзр = 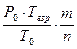 , где (4.9)
, где (4.9)
Р0 – начальное давление, кПа (МПа);
Т0 – начальная температура, К;
Твзр – температура взрыва, К;
m – число молей (киломолей) газообразных продуктов горения;
n – число молей (кисломолей) исходных газообразных веществ.
| Расчет максимального давления взрыва газов и паров | Пример 4.7. Вычислить максимальное давление взрыва смеси гексана С6Н14 с воздухом, если начальное давление 101,3 кПа, начальная температура 273 К, температура взрыва 2355 К. |
1. Уравнение реакции горения гексана в воздухе:
С6Н14 + 9,5(О2 + 3,76 N2) =6СО2 + 7Н2О + 9,5· 3,76 N2
2. Рассчитаем число молей (киломолей) газообразных веществ до и после взрыва:
m = 6 + 7 + 9,5×3,76 = 48,72 моль
n = 1 + 9,5×4,76 = 46,22 моль
3. Максимальное давление взрыва составит:
Рвзр =  = 921,1 кПа
= 921,1 кПа
Поиск по сайту: