 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Расчет объема воздуха, необходимого для горения
Расчет объема воздуха, необходимого для горения, предполагает вычисление
а) теоретического объема воздуха Vвтеор и б) практического объема воздуха Vвпр, затраченного на горение (с учетом коэффициента избытка воздуха).
Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vвтеор ).
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух DVв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен
Vвпр = Vвтеор + DVв (2.1)
и, следовательно, избыток воздуха будет равен
DVв= Vвпр - Vвтеор (2.2)
Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (a). Коэффициент избытка воздуха показывает, во сколько раз в зону горения поступило воздуха больше, чем это теоретически необходимо для полного сгорания вещества:
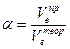 (2.3)
(2.3)
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха a = 1, при этом реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения.
При a > 1 горючую смесь называют бедной по горючему компоненту, а при a < 1 – богатой по горючему компоненту.
Избыток воздуха имеется только в смеси, бедной по горючему компоненту. Из формул (3.2) и (3.3) следует
DVв= Vвтеор(a -1) (2.4)
В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной концентрации кислорода в продуктах горения j (О2)ПГ. Для большинства органических веществ она составляет 12 – 16 % О2. Для некоторых веществ, например, ацетилена С2Н2, ряда металлов, горение возможно и при значительно меньшем содержании кислорода (до 5 % объемных О2).
Зная содержание кислорода в продуктах горения, можно определить коэффициент избытка воздуха (коэффициент участия воздуха в горении) на реальном пожаре:
 (2.5)
(2.5)
2 .1.1. Горючее – индивидуальное химическое соединение
Теоретический объем воздуха, необходимый для горения рассчитывается по уравнению реакции горения.
| Расчет теоретического объема воздуха, необходимого для горения индивидуального вещества | Пример 2.4. Какой теоретический объем воздуха необходим для полного сгорания 1 кг диэтилового эфира С2Н5ОС2Н5? Температура 100С, давление 1,2 ат |
1. Записываем уравнение реакции горения
1 кг х м3
С2Н5ОС2Н5 + 6(О2 + 3,76N2) =4СО2 + 5Н2О +6×3,76N2
М = 74 кг 6×4,76 × Vм =
=6×4,76×19,35 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса диэтилового эфира 74 кг/кмоль. Записываем эту величину под формулой эфира.
4. При нормальных условиях молярный объем (Vм) любого газообразного вещества составляет 22, 4 л/моль или 22,4 м3/кмоль.
Если условия отличаются от нормальных, то необходимо определить, какой объем будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет VМ ведут по формуле объединенного газового закона:
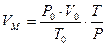 , где
, где
Р и Т – данные в задаче температура и давление.
Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
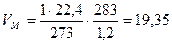 м3/кмоль
м3/кмоль
 Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6×4,76).
Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6×4,76).
5. По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания эфира:
Vвтеор = 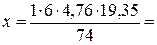 7,5 м3
7,5 м3
| Расчет объема воздуха, необходимого для горения индивидуального вещества | Пример 2.5. Какой объем воздуха необходим для полного сгорания 50 кг ацетона СН3СОСН3 при температуре 230С и давлении 95 кПа, если горение протекало с коэффициентом избытка воздуха 1,2? |
1. Записываем уравнение реакции горения
50 кг х м3
СН3СОСН3 + 4(О2 + 3,76N2) = 3СО2 + 3Н2О +4×3,76N2
М = 58 кг 4×4,76 × Vм =
=4×4,76×25,9 м3
2. Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
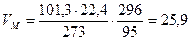 м3/кмоль
м3/кмоль
 3. По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания эфира:
3. По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания эфира:
Vвтеор = 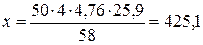 м3
м3
4. По условию задачи коэффициент избытка воздуха a = 1,2.
С учетом этого определим практический объем воздуха, необходимый для горения:
Vвпр = Vвтеор × a = 425,1 × 1,2 = 510,1 м3.
Поиск по сайту: