 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Гидролиз солей. С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов
С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
Гидролиз солей – процесс взаимодействия соли с водой, приводящий к образованию слабого электролита.
I. Соли, образованные сильным основанием и слабой кислотой.
Например, соль нитрит калия KNO2 образована сильным основанием KОН и слабой кислотой HNO2:

В водном растворе происходит полная диссоциация соли KNO2 = K+ + NO2–
(сильный электролит) и очень незначительная диссоциация молекул воды
| H2O | 
| OH– + H+ |
(очень слабый электролит):
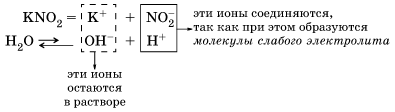
Запишем полное ионное уравнение происходящего процесса (гидролиза):
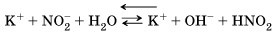
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), так как вода – значительно более слабый электролит, чем азотистая кислота HNO2.
Сокращенное ионное уравнение гидролиза:

Уравнение показывает, что:
1. в растворе есть свободные гидроксид-ионы ОН– и концентрация их больше, чем в чистой воде, поэтому раствор соли KNO2 имеет щелочную среду (pH > 7);
в реакции с водой участвуют анионы NO2–; в таком случае говорят, что идет гидролиз по аниону.
II. Соли, образованные сильной кислотой и слабым основанием.
Например, рассмотрим гидролиз иодида аммония NH4I.
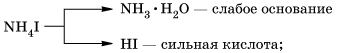
|
В водном растворе:

Полное ионное уравнение гидролиза:

Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, так как вода Н2О значительно более слабый электролит, чем гидрат аммиака NH3 ∙ H2O.
Сокращенное ионное уравнение гидролиза:

Уравнение показывает, что:
1.В растворе есть свободные ионы водорода Н+, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (pH < 7);
в реакции с водой участвуют катионы аммония NH4+; в таком случае говорят, что идет гидролиз по катиону.
2.В реакции с водой могут участвовать и многозарядные катионы: двухзарядные M2+ (например, Ni2+, Cu2+, Zn2+,...), кроме катионов
щелочноземельных металлов, трехразрядные M3+ (например, Fe3+, Al3+, Cr3+,...).
III. Соли, образованные слабым основанием и слабой кислотой.
Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу и по катиону, и по аниону.
Катион слабого основания связывает ионы ОН– из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н+ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов – кислоты и основания, которые образуются в результате гидролиза.
Соль Al2S3 образована слабым основанием Al(OH)3 и слабой кислотой H2S
Al2S3 = 2Al 3++ 3 S2-
Гидролиз идет и по катиону, и по аниону, т.к. они оба ведут к образованию слаб электролита. Реакция идет до конца с образованием соответствующих кислот и оснований: Al2S3 + HOH = Al(OH)3+H2S.
IV. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу.
Гидролиз не идет, т.к. при взаимодействии с водой слабый электролит не образуется. Раствор имеет нейтральную реакцию.
11. Основные классы неорганических соединений
Неорганические вещества по составу делят на простые и сложные
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления (–2). Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобразующие (CO2, N2O, NO). Солеобразующие делятся на основные (Na2O, MgO, CaO), амфотерные (Al2O3, ZnO), кислотные (CO2, P2O5,SO3, SiO2), которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
Основания – это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп
Основания делятся на растворимые (щелочи) и нерастворимые Примеры оснований:
NaOH, Ba(OH)2, Mg(OH)2.
Амфотерные гидроксиды – это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме основаниz
| Zn(OH)2 | или | H2ZnO2, |
| Al(OH)3 | или | H3AlO3 (HAlO2) |
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Общая формула кислот: Н x Ас, где Ac – кислотный остаток (от английского "acid" – кислота), х – число атомов водорода, равное заряду иона кислотного остатка Примеры кислот:
HCl, H2SO4, Н3РО4.
Кислоты делятся по основности: одноосновные (HCl, HNO3, HBr), двухосновные (H2SO4, H2CO3, H2S), трехосновные (H3PO4,H3SO4); по наличию кислорода: бескислородныq (H2S, HCl, HBr), киcлородсодержащие (H3PO4,H3SO4, H2CO3); по силе электролита: сильные (H2SO4, HCl), средней силы (H3PO4), слабые (H2CO3, H2S)
Соли – это сложные вещества, состоящие из катионов металла и анионов кислотных остатков.
Средние соли – это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками. H2SO4 → K2SO4, Fe(OH)2 → Fe(NO3)2
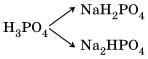
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например:

Основные соли – это продукты неполного замещения гидроксогрупп многокислотных основаниях кислотными остатками. Fe(OH)2 → FeOHCl, Cu(OH)2 → CuOHNO3
Помимо средних, кислых, основных солей вы встречались с солями более сложного строения – комплексными (двойные): Na [ Al(OH)4 ], K4 [ Fe(CN)6 ], [ Cu(H2O) 4 ] SO4 ∙ Н2О
12. Общая характеристика неметаллов
Поиск по сайту: