 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Степень электролитической диссоциации. Сильные и слабые электролиты
С. Аррениус для количественной характеристики электролитической диссоциации ввел понятие степени электролитической диссоциации, обозначаемой греческой буквой α.
Степень электролитической диссоциации – это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул.
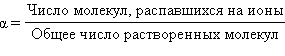
Если α = 0, то вещество совсем не распадается на ионы, оно является неэлектролитом. К неэлектролитам относятся вещества с ковалентными малополярными и неполярными связями, такие, как эфиры, углеводороды, кислород, азот и др.
Степень электролитической диссоциации может иметь значение от 0 до 1 (в процентах от 0 до 100 %).
Сильные электролиты – это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ионы. У таких электролитов степень диссоциации стремится к 1 (100 %). К сильным электролитам относятся почти все соли, неорганические кислоты (HNO3, HCl, HBr, HI, HClO4, НМnО4, H2SO4), щелочи (LiOH, NaОН, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2).
Слабые электролиты – это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. Их степень диссоциации значительно меньше 1 (100 %), в большинстве случаев она стремится к нулю. Но при разбавлении, как вы помните, степень диссоциации увеличивается.
К слабым электролитам относятся: многие неорганические кислоты (H2S, HF, H2CO3, H2SiO3, HNO2, H2SO3), органические кислоты, основания (за исключением щелочей), гидрат аммиака NH3 ∙ H2O, вода H2O, некоторые соли.
Различают три типа сред: нейтральную, щелочную, кислотную.
10.2. С точки зрения теории электролитической диссоциации основания - это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид - ион
NaOH Na++ OH-
Ba(OH)2 Ba2++ 2OH-
NH3·H2O NH4++ OH-
Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов таких веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остаткаH2SO4 2H+ + SO42-
CH3COOH H+ = CH3COO-
Поиск по сайту: