 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химические свойства галогенов
1. Взаимодействие галогенов с металлами с образованием галогенидов:
2Al + 3I2 = 2Аl+3I3-1 (иодид алюминия);
2Al + 3Br2 = 2Al+3Br3-1 (бромид алюминия).
2. Взаимодействие галогенов с водородом с образованием галогеноводородов (тип связи ― ковалентная полярная, тип решетки ― молекулярная). Сравнение скорости химических реакций разных галогенов с водородом позволяет повторить зависимость ее от природы реагирующих веществ. Так, фтор имеет настолько большую скорость реакции, что взаимодействует с водородом с взрывом даже в темноте. Реакция хлора с водородом при обычных условиях идет медленно и лишь при поджигании или освещении скорость ее растет во много раз (происходит взрыв). Еще медленнее взаимодействуют с водородом бром и йод, причем последняя реакция приобретает уже эндотермический характер:
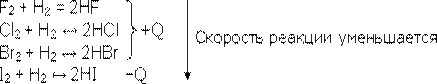
Только фтор взаимодействует с водородом необратимо, остальные галогены в зависимости от условий могут давать и обратимую реакцию.
Водные растворы галогеноводородов являются кислотами: HF ― фтороводородная (плавиковая), HCl ― хлороводородная (соляная), HBr ― бромоводородная, HI ― йодоводородная.
3. Галогены взаимодействуют с водой:
2F2 + 2Н2O = 4HF + O2
Вода во фторе горит, кислород является не причиной, а следствием горения, выступая в непривычной для него роли восстановителя.
4. Для характеристики способности одних галогенов (не атомов галогенов, а простых веществ) к вытеснению других из растворов их соединений можно использовать «ряд активности» галогенов, который записывается так:
F2 > Сl2 > Вr2 > I2,
т. е. окислительные свойства уменьшаются.
Фтор играет очень важную роль в жизни растений, животных и человека. Без фтора невозможно развитие костного скелета и особенно зубов. Содержание фтора в костях составляет 80-100 мг на 100 г сухого вещества. В эмали фтор присутствует в виде соединения Ca4F2(PO4)2 и придает ей твердость и белизну. При недостатке фтора в организме человека происходит поражение зубной ткани (кариес), а избыток его способствует заболеванию зубов флюорозом. Суточная потребность человека во фторе – 2-3 мг. Хлор (хлор-ион) более важен для жизнедеятельности животных и человека, чем для растений. Он входит в состав почек, легких, селезенки, крови, слюны, хрящей, волос. Ионы хлора регулируют буферную систему крови. Хлорид натрия является составной частью плазмы крови и спинномозговой жидкости и участвует в регуляции водного обмена в организме. Свободная соляная кислота входит в состав желудочного сока всех млекопитающих и активно участвует в пищеварении. У здорового человека содержится в желудке 0,2-0,3% соляной кислоты. Недостаток хлора в организме приводит к тахикардии, снижению артериального давления, судорогам. Достаточное количество хлора содержится в таких овощах как сельдерей, редис, огурцы, капуста белокочанная, укроп, перец, лук, артишок. Бром также входит в число необходимых микроэлементов и больше всего его содержится в гипофизе, крови. Щитовидной железе, надпочечниках. Бромиды в небольших дозах (0,1-0,3 взрослого человека) положительно действуют не центральную нервную систему как усилители процессов торможения в коре головного мозга. В природе бромиды накапливаются в таких растениях, как рожь, пшеница, ячмень, картофель, морковь, черешня, яблоки. Много брома содержится в голландском сыре. Йод в организме человека начинает накапливаться еще в утробе матери. В гормоне щитовидной железы человека ― тироксине ― содержится 60% связанного йода. Этот гормон с током крови поступает в печень, почки, молочные железы, желудочно-кишечный тракт. Недостаток йода в организме человека вызывает такие заболевания, как эндемический зоб и кретинизм, при котором замедляется рост и развивается умственная отсталость. В сочетании с другими элементами йод способствует росту и упитанности животных, улучшает их здоровье и плодовитость. Основными поставщиками йода для человека служат злаки, баклажаны, фасоль, капуста белокочанная и цветная, картофель, лук, морковь, огурцы, тыква, салат, морская капуста, кальмары.
15. 1. Кислород. Озон
В соединениях кислород обычно двухвалентен
Нахождения в природе. Кислород - самый распространенный химический элемент в земной коре. Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Получение кислорода
Получение в лаборатории. В лаборатории кислород получают при разложение некоторых сложных кислород содержащих веществ:
2H2Oпостоянный ток>2H2 + O2
2H2O2оксид магнезий>2H2O + O2
2HgO t >2Hg + O2
Кислород, выделяющийся в этих реакциях, можно собрать методом вытеснения воздуха или над водой.
Получение в промышленности. В промышленности кислород получают из воздуха, который представляет собой смесь различных газов; основные компоненты в нем - азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196oC) ниже температуры кипения жидкого кислорода (-183oC), то азот испаряется, а жидкий кислород остается. Газообразный кислород хранят в стальных баллонах под давлением 15 МПа.
Озо́н— состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Молекулярная масса — 48 а.е.м.
Плотность газа при нормальных условиях — 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху — 1,62 (1,658[6]).
Плотность жидкости при −183 °C — 1,71 г/см³
Температура кипения — −111,9 °C. Жидкий озон — тёмно-фиолетового цвета.
Температура плавления — −197,2 ± 0,2 °С (приводимая обычно т.пл. −251,4 °C ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению)[7]. В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом.
В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1: 100000.
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария.
Применение озона обусловлено его свойствами:
сильного окисляющего реагента:
для стерилизации изделий медицинского назначения
при получении многих веществ в лабораторной и промышленной практике
для отбеливания бумаги
для очистки масел
сильного дезинфицирующего средства:
для очистки воды и воздуха от микроорганизмов (озонирование)
для дезинфекции помещений и одежды
для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
15.2. Сера. Оксид серы. Серная кислота
Нахождение в природе: Самородная сера; сульфиды: свинцовый блеск PbS, медный блеск Сu2S, пирит FeS2, сероводород H2S; сульфаты: гипс CaSO4∙2H2O, горькая соль MgSO4∙7H2O, белки
Физические свойства: S-ромбическая ― желтые хрупкие кристаллы без запаха, не растворима в воде, ρ = 2 г/см3; S-пластическая ― коричнево-желтая, резиноподобная
Химические свойства: И окислительные, и восстановительные свойства
Получение: В промышленности: из самородных руд. В лаборатории: окислением сероводорода, сульфидов
Применение: Для получения серной кислоты; в сельском хозяйстве для борьбы с вредителями; производство спичек; вулканизация каучука, в производстве черного пороха.
Оксид серы. При обычных условиях SO2 - газ, SO3 - твёрдое вещество.
Проявляют свойства кислотных оксидов, взаимодействуя с водой:
SO2 + H2OH2SO3, SO3 + H2O = H2SO4
щелочами:
SO2 + 2NaOH = Na2SO4 + H2O, SO3 + 2NaOH = Na2SO4 + H2O
основными оксидами: SO3 + CaO = CaSO4
Получение:
1) оксида серы (IV) в промышленности:
горение серы: S + O2 = SO2
обжиг пирита: 4FeS2 + 11O2 = 2Fe2O3
в лаборатории: Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
2) оксида серы (VI) в промышленности: каталитическое окисление оксида серы (IV):
2SO2 + O2 = 2SO3
Серная кислота 1. При обычных условиях бесцветная тяжёлая жидкость (p ~ 2 г/см3), неограниченно растворимая в воде.
2. Сильная двухосновная кислота: H2SO4 = H+ + HSO4 2H+ + SO42-
3. Взаимодействует с металлами: Zn + H2SO4 = ZnSO4 + H2 В концентрированной кислоте пассивируются Al и Fe.
4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
5. Взаимодействует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
Получение в промышленности в соответствии со схемой: FeS2 (или S) O2 SO2 O2 SO3 H2O H2SO4
16.1. Азот. Аммиак. Азотная кислота
Азот бесцветный и нетоксичный, без запаха и вкуса. Азот существует в природе как невоспламеняющийся газ при нормальных температурах и давлении. Этот газ (азот) несколько легче воздуха, поэтому его концентрация с высотой повышается. При охлаждении до точки кипения азот превращается в бесцветную жидкость, которая при определенных давлении и температуре становится твердым бесцветным кристаллическим веществом. Азот слаборастворим в воде и большинстве других жидкостей, является плохим проводником электричества и тепла.
Большинство использований азота объясняется его инертными свойствами. Однако при высоких давлениях и температурах азот реагирует с некоторыми активными металлами, например с литием и магнием, образуя нитриды, а также с некоторыми газами, такими как кислород и водород.
При нормальных условиях это газ, не имеющий цвета, запаха и вкуса, тяжелее воздуха и практически инертный. При температуре -195,8 °C он переходит в жидкое состояние; при -209,9 °C – кристаллизуется, напоминая снег.
Области применения азот. В настоящее время, азот нашел широкое применение во всех сферах человеческой деятельности. Так, нефтегазовая промышленность использует его с целью регуляции уровня и давления в нефтяных скважинах, вытеснения кислорода из ёмкостей для хранения природного газа, продувки и тестирования трубопроводов. Химическая промышленность нуждается в нём для получения удобрений и синтеза аммиака, металлургия – для ряда технологических процессов. Благодаря тому, что азот вытесняет кислород, но не поддерживает горение, его применяют в пожаротушении. В пищевой промышленности упаковка продуктов в азотной атмосфере заменяет использование консервантов, препятствует окислению жиров и развитию микроорганизмов. Кроме того, это вещество используется в фармацевтике для получения различных препаратов и в лабораторной диагностике – для проведения ряда анализов. Жидкий азот способен за считанные секунды заморозить всё, что угодно, без образования кристалликов льда. Поэтому медики применяют его в криотерапии для удаления отмерших клеток, а также в криосохранении сперматозоидов, яйцеклеток и образцов тканей.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Получение аммиака
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия: катализатор – пористое железо, температура – 450 – 500 ˚С, давление – 25 – 30 МПа
Химические свойства аммиака
Для аммиака характерны реакции:
с изменением степени окисления атома азота (реакции окисления)
без изменения степени окисления атома азота (присоединение)
Реакции с изменением степени окисления атома азота (реакции окисления)
N-3 → N0 → N+2, NH3 – сильный восстановитель.
1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
аммиак – непрочное соединение, при нагревании разлагается2NH3↔ N2 + 3H2
Огромные количества аммиака используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
Азотная кислота HNO3 – одноосновная сильная кислота, при нормальных условиях бесцветная жидкость, является одним из важнейших продуктов химической промышленности.
Используется в производстве минеральных удобрений; в военной промышленности; в фотографии — подкисление некоторых тонирующих растворов; в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише), а также в производстве взрывчатых и отравляющих веществ.
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
б) с основаниями: KOH + HNO3 = KNO3 + H2O
в) вытесняет слабые кислоты из их солей
При кипении или под действием света азотная кислота частично разлагается.
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до -3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты
16.2 фосфор
Фосфор — аналог азота. Однако по сравнению с атомом азота атом фосфора характеризуется меньшей энергией ионизации и имеет больший радиус. Это означает, что неметаллические признаки у фосфора выражены слабее, чем у азота. Поэтому для фосфора реже встречается степень окисления -3 и чаще +5.
Физические свойства. Фосфор — один из распространенных элементов в земной коре. В свободном состоянии в природе фосфор не встречается из-за высокой химической активности. Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор в отличие от азота имеет несколько аллотропных модификаций: белый, красный, черный и др.
Белый фосфор — бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде. При длительном слабом нагревании белый фосфор переходит в красный.
Красный фосфор — порошок красно-бурого цвета, не ядовит. Нерастворим в воде и сероуглероде. Установлено, что красный фосфор представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами. Свойства красного фосфора во многом зависят от условий его получения.
Черный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Получается длительным нагреванием белого фосфора при очень большом давлении (200° С и 1200 МПа).Красный и черный фосфор при сильном нагревании возгоняются.
Нахождение в природе. Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca3(РО4)2Ч СаF2 и фосфатов Са3(РO4)2.
Получение. Обычно белый фосфор получают из фосфата кальция при нагревании его в смеси с песком и углем в электрической печи без доступа воздуха:

Красный фосфор можно получить при нагревании жидкого белого фосфора без доступа воздуха при температуре около 300 °С при небольшом давлении. При нагревании белого фосфора при большом давлении можно получить и черный фосфор Поскольку красный и черный фосфор являются полимерными модификациями, по сравнению с белым у них следует ожидать повышения температур плавления и температур кипения. Действительно, для красного фосфора Тпл составляет 600 °С (под давлением).
Применение. Красный фосфор применяется для производства спичек. Из красного фосфора, сульфида сурьмы (III), железного сурика [природного оксида железа (III) с примесью кварца] и клея приготовляют смесь, которую наносят на боковые поверхности спичечной коробки. Головка спичек состоит главным образом из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку спичечной коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево.
Белый фосфор широкого применения не имеет. Обычно его используют для образования дымовых завес. Черный фосфор применяется очень редко.
Химические свойства. В химическом отношении белый фосфор сильно отличается от красного. Так, белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240° С. При окислении белый фосфор светится в темноте — происходит непосредственное превращение химической энергии в световую.
В жидком и растворенном состоянии, а также в парах при температуре ниже 800° С фосфор состоит из молекул Р4. При нагревании выше 800° С молекулы диссоциируют: P4 «2P2. Последние при температуре выше 2000°С распадаются на атомы: P2«2P. Атомы фосфора могут объединяться в молекулы Р2, Р4 и в полимерные вещества. Очевидно, молекула P4, где атомы связаны между собой тремя s -связями, прочнее молекулы Р2, в которой атомы связаны одной s - и двумя p -связями. Уже при обычной температуре молекула P2.
Фосфор химически активен и непосредственно взаимодействует с большинством простых веществ. Электронная конфигурация внешнего слоя фосфора 3s23p3, поэтому для фосфора наиболее характерны степени окисления 5+ (Н3РO), 3+ (РСl3) и 3- (РН3).
Из трех аллотропных модификаций наиболее активным является белый фосфор. При обычных условиях на воздухе тонко измельченный фосфор самовоспламеняется:
При недостатке кислорода образуется оксид фосфора (III): 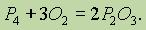
Поскольку температура плавления фосфора мала (44 °С), то давление насыщенных паров фосфора над твердым фосфором при обычных условиях достаточно велико — это и является причиной того, что белый фосфор “светится” в темноте. Молекулы P4 присутствующие в парах над поверхностью, окисляются кислородом с выделением света.
Красный и черный фосфор вступают в химические реакции при более высоких температурах. Аналогично азоту фосфор может взаимодействовать с металлами, образуя фосфиды, например: 
Фосфор соединяется со многими простыми веществами — кислородом, галогенами, серой, проявляя окислительные и восстановительные свойства:

При взаимодействии фосфидов с водой выделяется фосфин РН3:

Фосфин. РН3 — чрезвычайно ядовитый газ с чесночным запахом. По своим химическим свойствам он напоминает аммиак, однако, по сравнению с аммиаком является более сильным восстановителем.
Так же легко, как с кислородом, протекает взаимодействие фосфора с хлором, и в зависимости от условий образуется либо РСl3, либо PCl5.
17.1. Углерод. Оксид углерода. Угольная кислота
Углерод – основа органических, биоорганических соединений и многих полимеров.
Физические свойства.
Здесь в первую очередь, конечно, следует отметить высокую прочность простых соединений углерода.
Энергия связи между атомами углерода в простых и сложных веществах, в том числе и в алмазе, и в графите очень велика. О твердости алмаза уже говорили. Прочна связь между атомами и в графитовой сетке.
Например, прочность графита на разрыв волокна значительно превышает прочность железа и технической стали.
Тугоплавкость – еще одно уникальное свойство графита, т.к. температура плавления графита tпл выше 3500° С. В природе графит – самое тугоплавкое простое вещество.
Большая электрическая проводимость графита объясняется отсутствием на его поверхности каких-либо продуктов взаимодействия с окружающей средой, таких как оксиды на металлах.
Кроме того графит обладает способностью оказывать смазывающее действие на трущиеся поверхности. Объясняется это тем, что в кристалле графита атомы углерода прочно связаны между собой в плоских сетках, а связь между сетками слабая и имеет межмолекулярную природу (как в веществах с молекулярными решетками). Вследствие чего уже небольшие механические усилия вызывают смещение сеток относительно друг друга. Это обусловливает действие графита, как смазки.
Химические свойства углерода и его соединений.
Одно из главных химических свойств углерода – это сильные восстановительные свойства. Только при сравнительно низких температурах, углерод химически инертен.
химические свойства углерода: - горение в кислороде С+О2=СО2+Q;
- взаимодействие с оксидом углерода С+СО2=2СО;
- восстановление металлов из оксидов 3С+Fe2O3=3CO2+4Fe.
Поиск по сайту: