 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Cоединения галогенов
|
Читайте также: |
Соединения со степенью окисления –1. Наиболее важными соединениями галогенов в степени окисления -1 являются галогеноводороды, галогеноводородные кислоты и их соли.
Галогеноводороды, кроме HF, представляют собой токсичные газы с резким удушающим запахом. Молекулы фтороводорода сильно ассоциированы за счет прочных водородных связей, по этой причине HF имеет аномально высокую температуру кипения (19,6 °С). Фтороводород получают действием концентрированной серной кислоты на фториды. Эта же реакция используется для лабораторного получения хлороводорода:
t
NaCl(кр) + H2SO4(конц) = HCl + NaHSO4
В промышленности хлороводород получают прямым синтезом, бромоводород и иодоводород - гидролизом тригалогенидов фосфора, которые получают непосредственно в реакторе:
t
2P + 3Br2 + 6H2O = 2H3PO3 + 6HBr
Жидкий фтороводород является прекрасным ионизирующим растворителем, в котором многие вещества ведут себя как основания, поскольку взаимодействуя с HF, увеличивают концентрацию отрицательных ионов растворителя:
2HF  H+ + HF2-
H+ + HF2-
HNO3 + 2HF  NO3H2+ + HF2-
NO3H2+ + HF2-
основание
Кислотами в жидком фтористом водороде являются акцепторы фторид-аниона, например, фториды некоторых металлов:
SbF5 + HF  H+ + [SbF6]-
H+ + [SbF6]-
Галогеноводороды хорошо растворимы в воде, образуя растворы соответствующих кислот: HF - фтороводородная или плавиковая кислота, HCl - хлороводородная или соляная кислота, HBr - бромоводородная и HI - иодоводородная кислоты. Плавиковая кислота - кислота средней силы (Кa = 7×10-4), остальные галогеноводородные кислоты сильные, при переходе от HCl к HI сила кислоты увеличивается.
Концентрированная соляная кислота обычно представляет собой 37 % раствор хлороводорода. Бромистоводородная и иодистоводородная кислоты напоминают соляную, но менее устойчивы к окислению. Иодоводород окисляется уже кислородом воздуха:
4HI + O2 = 2I2 + 2H2O
Фтороводород, а также плавиковая кислота энергично разрушают стекло, поэтому кислоту хранят в пластиковой или парафинированной посуде:
SiO2 + 6HF = H2[SiF6] + 2H2O
Плавиковая кислота и фториды металлов токсичны, кислота при попадании на кожу вызывает сильные и долго не заживающие ожоги. Большинство солей плавиковой кислоты в воде плохо растворимы. Хорошо растворимы фториды натрия, калия и серебра. В отличие от других галогеноводородных кислот, плавиковая кислота образует кислые соли - производные димера (HF)2, например, KHF2 или KF×HF.
Большинство хлоридов (солей соляной кислоты) хорошо растворимы в воде. Малорастворимы AgCl, PbCl2, CuCl, Hg2Cl2. Образование белого творожистого осадка хлорида серебра используется как качественная реакция на хлорид-анион:
Ag+ + Cl- = AgCl¯
Хлорид натрия применяется для консервации и как пищевкусовая добавка, в химической промышленности для получения соды, хлора, гидроксида натрия. Хлорид калия используется в качестве удобрения.
К малорастворимым солям бромоводородной и иодоводородной кислот относятся бромиды и иодиды серебра и свинца(II), а также иодид ртути(II). Бромиды натрия и калия используют в медицине в качестве транквилизаторов. Иодид калия применяют при лечении заболеваний щитовидной железы. Бромид серебра используется в фотоделе в качестве светочувствительного материала.
К кислородсодержащим соединениям галогенов в степени окисления –1 относятся фториды кислорода: газообразный OF2 и кристаллический O2F2.
OF2 получают, пропуская фтор через разбавленный раствор гидроксида натрия при охлаждении:
2NaOH + 2F2 = 2NaF + H2O + OF2
При пропускании через смесь фтора и кислорода электрического разряда образуется O2F2 - желто-оранжевое кристаллическое вещество. Фториды кислорода - сильные окислители и фторирующие реагенты.
Соединения со степенью окисления +1. Известны оксиды хлора - Cl2O и брома - Br2O. Получить оксиды можно только косвенным путем. Например:
2Hg+2O + 2Сl20 = Hg2+1OCl2 + Cl2+1O
Молекула оксида хлора(I) имеет угловое строение, валентный угол равен 110°, гибридизация атомных орбиталей кислорода – sp3. Оксид хлора(I) - желто-бурый газ с резким запахом, ядовит. Оксид брома(I) – красно-коричневая жидкость (tпл = -17 °C). Эти вещества нестабильны, типичные кислотные оксиды.
Cl2O + H2O = 2HClO; Br2O + H2O = 2HBrO
Кислоты (HClO хлорноватистая, HBrO бромноватистая, HIO иодноватистая) неустойчивы, известны только в разбавленных растворах. В ряду HClO - HBrO – HIO устойчивость растет, все кислоты слабые, например, константа диссоциации HClO равна 5·10-8.
Соли гипохлориты, гипобромиты и гипоиодиты получаются диспропорционированием соответствующих галогенов в растворах щелочей при низкой температуре:
Э20 + 2NaOH ¾® NaЭ-1 + NaЭ+1O + H2O.
Все соединения галогенов со степенью окисления +1 сильные окислители. Соли склонны к реакции диспропорционирования, легко разлагаются, особенно в присутствии катализаторов:
3КЭ+1O = 2КЭ-1 + КЭ+5O3; 2КЭ+1O = 2КЭ-1 + O2.
Из солей наибольшее применение находит хлорная известь - смешанный гипохлорит-хлорид кальция - Ca(ClO)Cl(отбеливающее средство, средство для дегазации и дешевый окислитель). Получается при взаимодействии хлора с гашеной известью:
Cl2 + 2Сa(OH)2 ¾® СaCl2 + Сa(ClO)2 + 2H2O.
Степень окисления +1 также проявляется в соединениях с более электроотрицательными галогенами. Интергалогегиды образуются при непосредственном взаимодействии простых веществ. Например, фторид хлора(I) получают при нагревании сухих веществ выше 270 °С.
| Формула | Агрегатное состояние | Тпл., °С | Ткип., °С |
| ClF | бесцветный газ | -154 | -101 |
| BrF | газ красного цвета | -33 | +20 |
| BrCl | газ желтого цвета | -54 | +5 |
| ICl | твердое вещество красного цвета | +27 | 97 (разл.) |
| IBr | твердое вещество серого цвета | +42 | 119 (разл.) |
Интергалогениды данного типа очень неустойчивы за исключением ICl и ClF. Их кислотный характер подтверждается отношением к воде, а также их взаимодействием с однотипными производными щелочных и щелочноземельных металлов.
ClF + H2O = HClO + HF; ICl + H2O = HIO + HCl;
ClF + NaF = Na[ClF2]; ICl + NaCl = Na[ICl2].
дифторохлорат(I) дихлороиодат(I)
Иодиды щелочных металлов склонны в растворах присоединять молекулу иода с образованием полигалогенидов. Реакцию формально можно рассматривать как взаимодействие с кислотным иодидом иода(I):
I+1I-1 + KI-1 = K[I+1I2-1].
дииодоиодат(I)
К бинарным соединениям хлора в степени окисления +1 следует отнести нитрид хлора(I) – Сl3N. Молекула нитрида имеет геометрию тригональной пирамиды, с sp3-гибридизацией орбиталей атома азота. Соединение представляет собой темно-желтое масло с температурой плавления –27 °С, летучее, очень неустойчивое.. Кислотный характер соединения подтверждается реакцией гидролиза:
Cl3N + 3H2O = 3HClO + NH3
Соединения со степенью окисления +3. Соединения в степени окисления +3 немногочисленны, оксиды неизвестны, а соответствующие им анионы ЭO2- неустойчивы и легко диспропорционируют:
3HЭ+3O2 = 2HЭ+5O3 + НЭ-1
НClO2 даже в водном растворе быстро разлагается, представляет собой кислоту средней силы (Ка = 1·10-2), называемую хлористой. Хлориты щелочных и щелочноземельных металлов представляют собой белые кристаллические вещества, при нагревании легко диспропорционируют или разлагаются с выделением кислорода. NaClO2·3H2O применяют при отбеливании тканей и бумажной массы.
Известны интергалогениды со степенью окисления +3:
| Формула | Агрегатное состояние | Тпл., °С | Ткип., °С |
| ClF3 | светло-зеленый газ | -76,3 | +11,6 |
| BrF3 | жидкость | +8,8 | +125,8 |
| IF3 | твердое легкоплавкое вещество | - | - |
| ICl3 | желтые игольчатые кристаллы | - | - |
Молекулы тригалогенидов имеют Т-образное строение, сильные окислители, например, в парах ClF3 горят такие устойчивые вещества, как стеклянная вата, оксиды алюминия, магния и др.
2Al2O3 + 4ClF3 = 4AlF3 + 3O2 + 2Cl2
Это кислотные соединения, их гидролиз сопровождается диспропорционированием, например:
BrF3 + 2H2O = HBrO2 + 3HF
3HBr+3O2 = 2HBr+5O3 + НBr-1
3BrF3 + 6H2O = 2HBrO3 + НBr + 9HF
Трифториды брома и хлора применяют как фторирующие агенты, а BrF3 и IF3 - в качестве неводных растворителей при проведении специальных синтезов.
Соединения со степенью окисления +4. Оксид хлора(IV) - ClO2 ядовитый газ желтого цвета, взрывоопасный, получают, действуя на хлорат калия концентрированной серной кислотой:
КCl+5O3 + H2SO4 = KCl+7O4 + Cl+4O2 + K2SO4 + H2O
Молекула-радикал ClO2 имеет угловое строение, атомные орбитали хлора находятся в sp2-гибридизации, валентный угол 118 º:
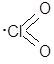
Оксид хлора(IV) является смешанным ангидридом двух кислот (хлористой и хлорноватой):
2Cl+4O2 + H2O = HCl+3O2 + HCl+5O3
Соединения со степенью окисления +5. Из оксидов в степени окисления +5 известен только оксид иода(V), твердое вещество, достаточно устойчивое к нагреванию, разлагается при температуре выше 300 ºС. Энергично взаимодействует с водой, образуя иодноватую кислоту:
I2O5 + H2O = 2HIO3
Известны соответствующие кислоты хлора и брома – хлорноватая и бромноватая. Хлорноватую и иодноватую кислоты получают обменной реакцией:
Вa(ЭO3)2 + H2SO4 = 2HЭO3 + BaSO4
Бромноватая кислота образуется в водных растворах при действии на соединения брома окислителей:
Br2 + 5Cl2 + 6H2O = 2HBrO3 + 10HCl
Хлорноватая кислота по свойствам напоминает азотную кислоту, её смесь с соляной кислотой – окислитель такой силы как "царская водка". Сила кислот в ряду HClO3 - HBrO3 - HIO3 несколько убывает, а устойчивость, наоборот, повышается. Если хлорноватая кислота устойчива только в растворах с концентрацией до 40 %, то HIO3 можно выделить в твердом состоянии – это бесцветные кристаллы с температурой плавления 110 °С. При нагревании HIO3 образуется соответствующий оксид - I2O5.
Соли кислот – хлораты, броматы и иодаты. Анион имеет геометрию тригональной пирамиды, атомные орбитали хлора находятся в sp3-гибридизации:
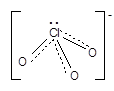
Наибольшее практическое значение имеет хлорат калия (бертолетова соль), его получают пропуская хлор через горячий раствор щелочи. КClO3 мало растворим в воде, поэтому его легко отделяют от KCl при охлаждении раствора.
>70 °C
3Cl2 + 6КOH ¾® 5КCl + КClO3 + 3H2O
При нагревании хлораты диспропорционируют, а в присутствии катализатора (MnO2) разлагаются с выделением кислорода:
4KCl+5O3 = 3KCl+7O4 + KCl-1; 2KCl+5O3 = 2KCl-1 + 3O2
Сильные окислители – хлораты – в смеси с восстановителями образуют легко взрывающиеся составы. Бертолетову соль используют в производстве спичек и фейерверков, хлорат натрия применяют в борьбе с сорняками. Иодаты значительно устойчивее соответствующих хлоратов и броматов, однако при сильном нагревании также разлагаются с выделением кислорода.
Из соединений в степени окисления +5 известны интер- и оксогалогениды:
| Формула | Агрегатное состояние | Тпл., °С | Ткип., °С |
| ClF5 | неустойчивый газ | -93 | -13 |
| ClОF3 | - | - | - |
| ClО2F | бесцветный газ | -115 | -6 |
| BrF5 | бесцветная жидкость | -62 | - |
| BrО2F IF5 IО2F | бесцветная жидкость
бесцветная жи  дкость
твердое вещество дкость
твердое вещество
| -9 +9,6 разл.>300 | - - - |
Гидролиз соединений данного типа идет по следующей схеме:
ClО2F + H2O = HClO3 + HF; BrF5 + 3H2O = HBrO3 + 5HF
С основными соединениями галогениды и оксогалогениды дают соответствующие соли, например:
IF5 + KF = K[IF6]; IF5 + 6KOH = KIO3 + 5KF+ 3H2O
Соединения со степенью окисления +7. Оксид известен только для хлора - Cl2O7. Это бесцветная жидкость (т.пл. –93,4 °С, т.кип. +83 °С). Получается при нагревании хлорной кислоты с оксидом фосфора(V):
2HClO4 + P2O5 = Cl2O7 + 2H3PO4
Молекула Cl2O7 полярна (m = 0,24·10-29 Кл·м), в ней согласно электронографическому исследованию два тетраэдра объединены через атом кислорода. Длина связи между атомами хлора и терминальными атомами кислорода составляет 0,172 нм, а между хлором и мостиковым атомом кислорода – 0,142 нм.
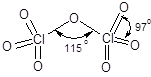
Оксид хлора(VII) относительно устойчив, но при нагревании выше 120 °С разлагается со взрывом. Оксиду соответствует хлорная кислота:
Cl2O7 + H2O = 2HClO4
Анион ClO4- имеет тетраэдрическое строение, что в рамках теории валентных связей соответствует sp3-гибридизации валентных орбиталей атома хлора, стабилизированной за счет p-связей:
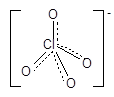
Хлорную кислоту получают действием на хлораты концентрированной серной кислотой:
KClO4 + H2SO4 = HClO4 + KHSO4
Хлорная кислота - одна из самых сильных минеральных кислот, это бесцветная жидкость (т.пл. –102 °С) хорошо растворимая в воде, способная взрываться. В следствие повышения устойчивости анионов в ряду: ClO- - ClO2- - ClO3- - ClO4- окислительная способность соединений уменьшается, а сила кислот растет. Из солей хлорной кислоты наибольшее значение имеет KClO4, который получают электролизом раствора KClO3.
Бромная кислота - HBrO4 - в свободном состоянии не выделена, но получены её водные растворы. Ее устойчивые соли - перброматы получают по следующей реакции:
NaBrO3 + 2NaOH + F2 = NaBrO4 + H2O + 2NaF
По силе бромная кислота приближается к хлорной, а по окислительной активности она сильнее. Для иода в степени окисления +7 характерно образование ортокислоты – H5IO6 – это бесцветное кристаллическое вещество (т.пл. 122 °С), растворимое в воде. Кислотные свойства иодной кислоты выражены слабее, чем хлорной (К1= 2,8·10-2, К3= 2,5·10-13). Периодаты получают либо реакцией диспропорционирования иодатов, либо их окислением:
5Ba(IO3)2 = Ba5(IO6)2 + 4I2 + 9O2;
KIO3 + 6KOH + Cl2 = K5IO6 + 2KCl + 3H2O
Из соединений в степени окисления +7 известны галогениды и оксогалогениды:
| Формула | Агрегатное состояние | Тпл., °С | Ткип., °С |
| ClO3F | бесцветный газ | -147,8 | -46,7 |
| BrF7 | неустойчивый газ | - | - |
| IF7 IО3F | неустойчивый газ белое кристаллическое вещество | - разл.>90 | - - |
Триоксофторид хлора, в отличие от остальных соединений, обладает высокой термической и гидролитической устойчивостью: он не разлагается и не гидролизуется даже при температуре 260 °С. Его кислотная природа проявляется при взаимодействии с концентрированными растворами щелочей:
ClО3F + 2NaOH = NaClO4 + NaF + H2O
Литература: [1] с. 338 - 359, [2] с. 415 - 423, [3] с. 270 - 296
Поиск по сайту: