 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Соединения бора
Металлические соединения бора. С металлами бор образует бориды состава: М4В, М2В, МВ, М3В4, МВ2, МВ6. Бориды s-элементов химически активны, разлагаются кислотами образуя смеси бороводородов. Большинство боридов d- и f-элементов очень тверды и химически устойчивы. Жаропрочные бориды таких d-элементов, как Cr, Zr, Ti, Nb, Ta, применяют для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр.
Соединения со степенью окисления +3. Важнейшими соединениями бора являются гидриды, галогениды, оксид, борные кислоты и их соли.
Оксид бора - B2O3 - бесцветная хрупкая стеклообразная масса, кислотный оксид, энергично присоединяет воду с образованием ортоборной кислоты:
B2O3 + 3H2O = 2H3BO3
H3BO3 - очень слабая одноосновная кислота, причем ее кислотные свойства проявляются не за счет отщепления катиона водорода, а за счет связывания гидроксид-аниона:
H3BO3 + H2O  H+ + [B(OH)4]-; рКа = 9,0
H+ + [B(OH)4]-; рКа = 9,0
При нагревании борная кислота ступенчато теряет воду, образуя вначале метаборную кислоту, а затем оксид бора:
- H2O - H2O
H3BO3 ¾® HBO2 ¾® B2O3
При взаимодействии со щелочами образует тетрабораты - соли гипотетической тетраборной кислоты:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
Большинство солей – боратов – в воде нерастворимы, исключение составляют бораты s-элементов. Более других используется тетраборат натрия Na2B4O7. В большинстве своем бораты полимерны, выделяются из растворов в виде кристаллогидратов. Полимерных борных кислот из раствора выделить не удается, в связи с тем, что они легко гидратируются. Поэтому при действии кислот на полибораты обычно выделяется борная кислота (эта реакция используется для получения кислоты):
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
Безводные метабораты получают сплавлением оксида бора или борной кислоты с оксидами металлов:
CaO + B2O3 = Ca(BO2)2
Гидриды бора. Простейший гидрид бора - BH3 - не существует, поскольку атом бора в данной молекуле должен содержать на внешнем уровне шесть электронов вместо восьми (завершенный электронный уровень). Электронодефицитность бора компенсируется за счет образования мостиковых связей с атомом водорода.

В молекулах других бороводородов наряду с мостиковыми и терминальными (концевыми) связями бор - водород образуются связи бор - бор, что приводит к образованию более сложных структур. Например, молекула тетраборана имеет следующее строение:
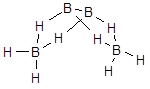
Обычным методом получения бороводородов (боранов) является гидролиз боридов металлов, например:
6MgB2 + 12HCl = B4H10 + 8B + 6MgCl2 + H2
Большинство боранов ядовиты и имеют отвратительный запах. Из выделенных в свободном состоянии гидридов простейшими представителями являются: B2H6, B4H10 – газы, B5H9, B6H10 – жидкости, B10H14 – твердое вещество.
Бороводороды - реакционноспособные вещества, на воздухе горят, многие самовоспламеняются, разлагаются водой:
B2H6 + 3O2 = B2O3 + 3H2O; B2H6 + 6H2O = 2H3BO3 + 6H2
Будучи соединениями кислотными бораны с основными гидридами образуют анионные комплексы, например:
B2H6 + 2LiH = 2Li[BH4];
тетрагидридоборат лития
AlСl3 + 3Li[BH4] = Al[BH4]3 + 3LiCl
Гидридобораты щелочных металлов имеют связь, близкую к ионной, в водных растворах медленно гидролизуются, являются активными восстановителями. Гидридобораты алюминия и бериллия – полимерны, на воздухе взрываются.
Бороводороды и органические соединения бора широко применяются в качестве ракетного топлива.
Галогениды бора известны для всех галогенов. Молекулы галогенидов имеют форму плоского треугольника с атомом бора в центре (sp2-гибридное состояние). В обычных условиях фторид BF3 – газ, BCl3 и BBr3 – жидкости, BI3 – твердое вещество. Все они бесцветны. Могут быть получены из простых веществ при нагревании. Фторид в промышленности получают нагреванием оксида бора с фторидом кальция в присутствии концентрированной серной кислоты:
B2O3 + 3CaF2 + 3H2SO3 = 2BF3 + 3CaSO4 + 3H2O
Получение хлорида основано на хлорировании раскаленной смеси оксида бора и угля:
B2O3 + 3C + 3Cl2 = 2BCl3 + 3CO
Галогениды бора, особенно фторид, сильнейшие акцепторы электронов (кислоты Льюиса), легко реагируют с донорами электронной пары:
BF3 + KF = KBF4; BF3 +: NH3 = F3B: NH3
тетрафтороборат калия
Кислотная природа галогенидов проявляется при их гидролизе, который протекает необратимо. Вследствие этого BCl3 и BBr3 на влажном воздухе дымят, а взаимодействие иодида бора с водой идет со взрывом.
BCl3 + 3H2O = H3BO3 + 3HCl
Нитрид бора - BN - получается прямым взаимодействием простых веществ и существует в двух модификациях: графито- и алмазоподобной (боразон или эльбор). В гексагональной слоистой структуре типа графита атомы бора и азота находится в sp2-гибридизации. В отличие от графита BN белого цвета полупроводник, легко расслаивается, огнеупорен (т.пл. ~3000 ºС). Очень медленно разлагается водой при нагревании.
Алмазоподобный нитрид бора имеет кубическую кристаллическую решетку (sp3-гибридизация атомов), получают его из гексагональной модификации при 1800 ºС и давлении 60 – 80 тыс.атм. Эльбор (боразон) очень твердый материал, некоторые его образцы царапают алмаз. При этом он термически устойчив до 2000 °С, инертен, диэлектрик. Используется для обработки твердых материалов.
Поиск по сайту: