 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Соединения маргнаца, технеция и рения
Соединения со степенью окисления 0. Нулевая степень окисления проявляется в карбонилах. Для марганца и его аналогов известны карбонилы состава Э2(СО)6, например:
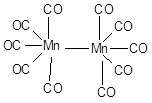
В обычных условиях желтый Mn2(СО)6, бесцветные Tc2(СО)6 и Re2(СО)6 - твердые легко возгоняющиеся вещества. Эти соединения парамагнитны, следовательно атомам металла в карбониле можно приписать электронную конфигурацию (n-1)d7:
| d7 | ns | np | ||||||||
| ¯ | ¯ | ¯ | |
на p-связи ® ¾ на s-связи с молекулами СО ¾®
Металл за счет пяти вакантных гибридных орбиталей (d2sp3) присоединяет пять молекул СО. Устойчивость связи повышается за счет p-дативного взаимодействия, в котором принимают участие электронные пары металла и вакантные p-разрыхляющие орбитали молекул СО. За счет неспренного электрона образуется d-связь металл-металл.
Соединения со степенью окисления +2. Оксид марганца(II) - MnO - зеленое кристаллическое вещество с полупроводниковыми свойствами. Получают разложением карбоната марганца(II) в атмосфере азота или восстановлением водородом оксида марганца(IV):
700 ºС
MnCO3 = MnO + СО2; MnO2 + Н2 ¾® MnO + Н2O
Амфотерный оксид с явным преобладанием основных свойств, растворим в кислотах, в воде нерастворим. Кислотные свойства проявляются при сплавлении со щелочами или основными оксидами:
t
MnO + K2O = K2MnO2
При нагревании на воздухе окисляется:
2MnO + O2 = 2MnO2
Гидроксид марганца(II) - Mn(OH)2 - аморфный белый осадок, образующийся при действии щелочей на соли марганца(II):
Mn2+ + 2OH- = Mn(OH)2
В воде малорастворим, слабое основание. Легко взаимодействует с кислотами, со щелочами реагирует только при сплавлении или длительном нагревании:
Mn(OH)2 + 4OH- = [Mn(OH)6]4-
Легко окисляется кислородом:
2Mn(OH)2 + O2 = 2MnO2 + 2H2O
Большинство солей марганца(II) хорошо растворимы в воде. Малорастворимы фторид MnF2, карбонат MnCO3, фосфат Mn3(PO4)2 и цианид Mn(CN)2. Катион [Mn(H2O)6]2+ имеет слабую розовую окраску, такую же окраску имеют кристаллогидраты солей марганца(II).
Координационные соединения марганца(II) многочисленны. Ниже приведены некоторые способы их получения:
Mn(CN)2 + 4KCN = K4[Mn(CN)6];
MnF2 + 4KF = K4[MnF6]; MnCl2 + 2KCl = K2[MnCl4];
Большинство координационных соединений (кроме цианидных) в разбавленных растворах распадаются.
При действии окислителей соединения марганца(II) проявляют восстановительные свойства. Так в сильно щелочной среде окисление сопровождается образованием манганатов, в кислой среде – перманганатов.
сплавление
3Mn+2SO4 + 2KClO3 + 12KOH ¾® 3K2Mn+6O4 + 2KCl + 3K2SO4 + 6H2O;
2Mn+2SO4 + 5PbO2 + 6HNO3 = 2HMn+7O4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O
Соединения со степенью окисления +4. Основным соединением марганца(IV) является его диоксид - MnO2 – темно-коричневое вещество, нерастворимое в воде, химически довольно инертное. MnO2 – амфотерный оксид с явным преобладанием кислотных свойств.
t
MnO2 + СаO = СаMnO3
манганит кальция
Оксид марганца(IV) может проявлять свойства как окислителя, так и восстановителя:
Mn+4O2 + 4HCl = Mn+2Cl2 + Cl2 + 2H2O;
3Mn+4O2 + KClO3 + 6KOH = 3K2Mn+6O4 + KCl + 3H2O
Для технеция и рения со степенью окисления +4 известны оксиды, галогениды, а также М+12ЭO3 и М+12ЭCl6. Производные технеция(IV) устойчивее однотипных соединений марганца и рения.
Соединения со степенью окисления +6. Соединения, в которых степень окисления марганца и его аналогов равна +6, немногочисленны. Из них наиболее устойчивы фториды, хлориды, оксогалогениды и оксиды рения и технеция. Например:
| Формула | Агрегатное состояние | Тпл., °С | Ткип., °С |
| ReF6 | светло-желтая жидкость | +19 | +34 |
| ReOF4 | синие кристаллы | +108 | +172 |
| ReO3 | красные кристаллы | +160 | - |
Этим соединениям соответствуют анионные комплексы, например:
ReF6 + 2КF = K2[ReF8]
Степень окисления +6 марганца несколько стабилизируется в манганат-анионе MnO4-2. Манганаты, технаты и ренаты темно-зеленого цвета в водных растворах существуют только при избытке щелочи, в противном случае диспропорционируют по следующей схеме:
3MnO4-2 + 2H2O = 2MnO4- + MnО2 + 4ОН-
Манганаты – сильные окислители, особенно в кислой среде. Однако в присутствии более сильных окислителей они окисляются до перманганат-аниона. Например:
MnO42- + 4H+ + 2e- ® MnО2 + 2H2O; E0 = 2,26 В;
2К2Mn+6O4 + Сl2 = 2KMn+7О4 + 2KCl
Соединения технеция(VI) и рения(VI) легко окисляются даже кислородом воздуха:
4К2Э+6O4 + О2 + 2H2O = 4KЭ+7О4 + 4KОН
Соединения со степенью окисления +7. Соединения марганца(VII): оксид - Mn2O7, марганцевая кислота - HMnO4 и ее соли. Оксид марганца(VII) получается при действии концентрированной серной кислоты на перманганат калия:
2KMnO4 + 2H2SO4 = Mn2O7 + 2KHSO4 + H2O
Mn2O7 - темно-зеленая жидкость, крайне неустойчив, разлагается со взрывом. Типичный кислотный оксид, реагирует с водой с образованием марганцевой кислоты:
Mn2O7 + H2O = 2HMnO4
Марганцевая кислота - HMnO4 - сильная кислота, устойчива только в разбавленных растворах. Перманганат-анион – красно-фиолетового цвета. Соли - перманганаты - более устойчивы, но при нагревании разлагаются с выделением кислорода:
t
2KMnO4 = K2MnO4 + MnO2 + O2
Перманганат-анион – сильнейший окислитель, глубина восстановления которого зависит от рН раствора:
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O; E0 = 1,58 В; (рН < 7)
MnO4- + 2H2O + 3e- ® MnO2 + 4OH-; E0 = 1,23 В; (рН = 7)
MnO4- + 1e- ® MnO42-; E0 = 0,56 В (рН > 7)
Оксиды технеция(VII) и рения(VII) – желтые вещества, устойчивы, не проявляют окислительных свойств. Растворяются в воде, образуя сильные кислоты. В ряду HMnO4 - HТсO4 - HReO4 – сила кислот несколько уменьшается. В свободном состоянии выделена только технециевая кислота HТсO4. Анион ТсO4- - розового цвета, ReO4- – бесцветен. Большинство солей – пертехнаты и перренаты – хорошо растворимы в воде. Сравнительно трудно растворимы соли калия, рубидия и цезия.
Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548
Поиск по сайту: