 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Схема образования s и p-дативной связей в карбонилах

Соединения со степенью окисления +2 и +3. В степени окисления +2 хром образует основной оксид – CrO (черного цвета), соответствующий ему гидроксид - Cr(OH)2 (желтого цвета) и соли.
Соединения хрома(II) получают восстановлением соединений со степенью окисления +3, например, атомарным водородом в кислых растворах:
Cr+3 + ·H = Cr+2 + H+
Бинарные соединения хрома(II) проявляют основные свойства. Например, гидроксид хрома взаимодействует только с кислотами, образующиеся при этом растворы солей окрашены в синий цвет:
Сr(OH)2 + 2H+ + 4H2O = [Cr(H2O)6]2+
Галогениды хрома(II) легко поглощают аммиак, образуя аммиакаты состава [Cr(NH3)6]2+.
Все соединения хрома(II) - сильные восстановители, катион хрома(II) окисляется даже водой:
2CrCl2 + 2H2O = 2Cr(OH)Cl2 + H2
Степень окисления +3 для хрома наиболее устойчива и реализуется в оксиде - Cr2O3, гидроксиде - Cr(OH)3 и солях хрома(III). Оксид хрома(III) - темно-зеленый мелкокристаллический порошок, химически очень инертен. При сплавлении проявляет свойства амфотерного оксида:
t
Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4;
t
Cr2O3 + 2KOH = 2KCrO2 + H2O
хромит калия
Гидроксид хрома(III) осаждается щелочами из водных растворов солей хрома(III) и представляет собой аморфное вещество серо-синего цвета, имеющее переменный состав Cr2O3×nH2O. Свежеосажденный гидроксид легко растворяется в растворах кислот и щелочей:
+ H+ + OH-
[Cr(H2O)6]3+ ¾ Cr(OH)3 ¾® [Cr(OH)6]3-
Соли Cr+3 окрашены в изумрудно-зеленый цвет, выделяются из растворов в виде кристаллогидратов с большим содержанием воды: CrCl3×6H2O, Cr2(SO4)3×12H2O, K2SO4×Cr2(SO4)3×24H2O. Сульфат хрома и хромокалиевые квасцы широко применяются при выделке кож. Безводные соли хрома(III) имеют полимерное строение и в воде нерастворимы.
Анионные комплексы для хрома(III) весьма разнообразны, координационное число центрального атома в них обычно равно 6.
Сr(OH)3 + 3КОН = К3[Cr(ОH)6]; СrСl3 + 3КCl = К3[CrCl6];
зеленый красно-розовый
Сr2(SO4)3 + 3H2SO4 = 2H3[Cr(SО4)3]
желтый
Кластерные соединения. Для d-элементов характерны соединения, в которых содержатся группировки из двух и более атомов металла, связанных друг с другом. Такие соединения называются кластерами (с англ. cluster – гроздь, рой).
Первым кластером, строение которого достоверно установлено, был ацетат хрома(II), димерная структура которого выявлена еще в 1953 году. Ацетат-анионы в структуре данного соединения выполняют бидентатно-мостиковую функцию, атомы хрома связаны четырехкратной связью друг с другом.
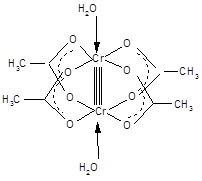
К двухядерным кластерам относятся соединения молибдена(II) [Мо2Cl8]4-, хрома(III) [Cr2Cl9]3- и вольфрама(III) [W2Cl9]3-. В отличие от кластерного галогенида хрома в соединениях молибдена и вольфрама осуществляется связь металл-металл:
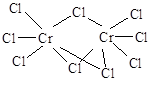
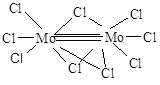
Примерами шестиядерных кластеров являются хлориды молибдена(II) и вольфрама(II) состава [Э6Cl8]Cl4. Аналогичное строение имеют бромиды вольфрама и молибдена.
Соединения со степенью окисления +6. Степень окисления +6 реализуется в галогенидах, оксогалогенидах, оксидах хрома, молибдена и вольфрама, а также в некоторых анионных комплексах. В ряду соединений Cr(VI) – Mo(VI) – W(VI) устойчивость заметно повышается.
Оксиды - кристаллические вещества: CrO3 - красного цвета, MoO3 - белый, WO3 - желтый. Оксид хрома(VI) выпадает из раствора дихромата калия при его подкислении концентрированной серной кислотой:
К2Cr2O7 + H2SO4 = 2CrO3¯ + K2SO4 + H2O
Оксид хрома(VI) ядовит, хорошо растворяется в воде, образуя хромовую кислоту:
CrO3 + H2O = H2CrO4
Оксиды молибдена и вольфрама получают прямым синтезом, они нерастворимы в воде, реагируют с щелочами, образуя соли:
ЭO3 + 2KOH = K2ЭO4 + H2O
Соли - молибдаты и вольфраматы бесцветны, хроматы окрашены в желтый цвет. При подкислении раствора хроматы переходят в дихроматы и далее в полихроматы. Переход обратим и при подщелачивании раствора вновь образуются хроматы:
CrO42- + 2H+ = Cr2O72- + H2O; Cr2O72- + 2OH- = 2CrO42- + H2O
Все хроматы содержат анионы, образованные тетраэдрами CrO42-, соединенными в цепь. Строение дихромат-аниона показано ниже:

Соединения молибдена(VI) и вольфрама (VI) явно выраженными окислительными свойствами не обладают. Хроматы и дихроматы - сильные окислители, восстанавливаются до соединений хрома(III):
K2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3NaNO3 + 4H2O;
K2Cr2O7 + 3NaNO2 + 4H2O = 2Cr(OH)3 + 2KOH + 3NaNO3;
2K2CrO4 + 3NaNO2 + 2KOH + 5H2O = 2K3[Cr(OH)6] + 3NaNO3
Для хрома(VI) известны пероксокомплексы, например, соединение голубого цвета CrO(O2)2L, где L – молекулы воды или эфира. Координационное соединение образуется при обработке кислого раствора дихромата калия перекисью водорода:
K2Cr2O7 + 4Н2О2 + H2SO4 + L = 2CrO2(O2)2L + K2SO4 + 5H2O
Координационный полиэдр соединения имеет геометрию пентагональной пирамиды: в основании пирамиды расположены атомы кислорода пероксид-ионов и лиганд L, в вершине – атом кислорода:

Поиск по сайту: