 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Элементы триады железа
Железо один из наиболее распространенных металлов земной коры (2 мол.%). Основные минералы: Fe3O4 - магнетит, Fe2O3 - гематит, Fe2O3×nH2O - лимонит, FeCO3 - сидерит, FeS2 - пирит Кларк кобальта составляет 0,0015 мол.%. Кобальт образует небольшое число минералов, основным из которых является кобальтин (кобальтовый блеск) - CoAsS.
Никель - довольно распространенный элемент земной коры, его кларк составляет 0,0032 мол.%, обычно содержится в сульфидных медно-никелевых рудах. Известно несколько самостоятельных минералов, из которых наибольшим содержанием никеля отличается миллерит - NiS.
Железо и никель - серебристо-белые металлы, кобальт - блестящий белый металл с серым оттенком.
| Свойства | Fe | Co | Ni |
| Плотность, г/см3 | 7,87 | 8,90 | 8,91 |
| Т.пл., °С |
В промышленности железо и его сплавы (чугун) получают восстановлением оксидов железа оксидом углерода(II) при высоких температурах:
+ CO + CO + CO
Fe2O3 ¾® Fe3O4 ¾® FeO ¾® Fe
Очень чистое железо получают термическим разложением его пентакарбонила:
Fe(CO)5 ¾® Fe + 5CO
Кобальт и никель получают в результате ряда пирометаллургических операций из NiO и Со3О4, восстанавливая оксид чаще всего коксом.
Основная область применения железа - это использование его в виде сплавов, преимущественно, чугуна и сталей. Чугун - сплав на основе железа с содержанием углерода в виде графита и цементита (Fe3C) выше 2%. Специальные марки чугуна содержат в своем составе и другие элементы, например, ферросилиций (12-14% кремния), ферромарганец (60-90% марганца), зеркальный чугун (12% кремния, 20% марганца). Стали - сплавы железа с содержанием углерода 0,1 - 2%. По химическому составу выделяют углеродистые и легированные стали (легирующие добавки других металлов придают стали новые технологические свойства).
Основное количество кобальта и никеля идет на производство твердых сплавов и сверхтвердых металлокерамических композиций. Большое значение кобальт и никель имеют как легирующие добавки к сталям. Никель используется для изготовления коррозионно-устойчивой посуды и аппаратуры, для нанесения защитных покрытий. Мелкодисперсные кобальт и никель применяются как катализаторы процессов гидрирования и дегидрирования углеводородов.
Железо играет важную роль в жизнедеятельности животных и человека, входит в состав гемоглобина, миоглобина и в состав некоторых ферментов. Наряду с серой железо входит в состав ферредоксинов - переносчиков электронов в биохимических процессах. Катионы кобальта(III) входят в состав витамина В12, играющего важную роль в процессе образования эритроцитов.
Химические свойства железа. Железо - металл средней химической активности. В компактном состоянии в атмосфере сухого воздуха устойчиво, во влажном воздухе корродирует. Примеси сильно ускоряют данный процесс. При нагревании до температуры белого каления железо энергично окисляется кислородом:
3Fe + 2O2 = Fe3O4
При высоких температурах окисляется галогенами и серой:
t + S + S
2Fe + 3Cl2 = 2FeCl3; Fe ¾® FeS ¾® FeS2
С фосфором, углеродом и кремнием железо образует соединения переменного состава: Fe3P, Fe2P, FeP, Fe3Si2, FeSi, FeSi2, Fe3C.
При повышенных температурах железо окисляется парами воды и аммиака:
800 °С t
3Fe + 4H2O ¾® Fe3O4 + 4H2; 4Fe + 2NH3 ¾® 2Fe2N + 3H2
В ряду стандартных электродных потенциалов железо стоит левее водорода:
Fe2+ + 2e- ¾® Fe; E0 = -0,44 B
Легко растворяется в водных растворах кислот с образованием солей железа(II). Концентрированная азотная и серная кислоты на холоду железо пассивируют, при нагревании реагируют с образованием солей железа(III).
Химические свойства кобальта. По химической активности кобальт несколько уступает железу. При обычной температуре компактный кобальт устойчив к действию сухого и влажного воздуха, воды, щелочей и разбавленных растворов органических кислот. При 300 °С окисляется кислородом воздуха, при нагревании взаимодействует с галогенами, серой, углеродом:
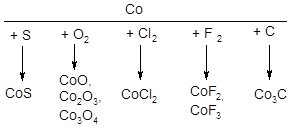
С фосфором, мышьяком, кремнием и бором образует соединения переменного состава. Не реагирует с азотом, но при нагревании до температуры красного каления реагирует с аммиаком, сероводородом и водой.
По сравнению с железом кобальт более устойчив к действию кислот, медленно растворяется в разбавленной соляной и серной кислоте, быстро - в разбавленной азотной кислоте, с образованием солей кобальта(II). Концентрированная азотная кислота кобальт пассивирует. Со щелочами кобальт практически не взаимодействует.
Химические свойства никеля. По химической активности никель уступает железу и кобальту, он не корродирует в воде, на воздухе и в различных растворах. Кислородом окисляется при температуре выше 500 °С. При нагревании никель, особенно в измельченном состоянии, реагирует с галогенами и серой с образованием соответствующих бинарных соединений:
Ni + Cl2 = NiCl2; Ni + S = NiS
При высоких температурах Ni реагирует также с фосфором, углеродом, кремнием и бором с образованием соединений переменного состава (твердых растворов). При 600 °С никель реагирует с водой:
Ni + H2O = NiO + H2
При незначительном нагревании взаимодействует с оксидом углерода с образованием тетракарбонила:
Ni + 4CO = Ni(CO)4
Разбавленные соляная, азотная и серная кислота медленно растворяют никель с образованием солей Ni2+. Концентрированная азотная кислота на холоду никель пассивирует. По отношению к щелочам никель устойчив.
Поиск по сайту: