 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Аморфный углерод
Кристаллический углерод
· Алмаз
· Графит
· Карбин
· Фуллерены
Аморфный углерод
- Активированный уголь
- Древесный уголь
- Ископаемый уголь: антрацит и др.
- Кокс каменноугольный, нефтяной и др.
- Сажа
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др.
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом по распространённости в земной коре кремний занимает второе место после кислорода.
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты.
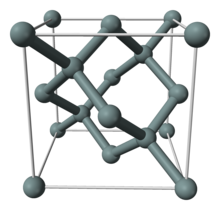

Кристаллическая структура кремния.
Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза.
При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют лишь некоторые кислоты, являющиеся сильными окислителями. Например, в присутствии окислителей (KClO3, MnO2) аморфный углерод растворяется в концентрированных азотной и серной кислотах при нагревании. Кремний же растворяется лишь в смеси азотной и плавиковой кислот:
3Si + 18HF + 4HNO3 = 3H2SiF6 + 4NO + 8Н2О
Щелочи переводят кремний в соли кремниевой кислоты с выделением водорода:
Si + 2КОН + H2O = К2Si03 + 2Н2
С водой углерод и кремний реагируют лишь при высоких температурах:
С + Н2О à СО + Н2
Si + ЗН2О = Н2SiO3 + 2Н2
Первая из этих реакций имеет большое практическое значение. Она лежит в основе процесса газификации твердого топлива.
Углерод в отличие от кремния непосредственно взаимодействует с водородом:
С + 2Н2 = СН4
Реакция осуществляется при нагревании в присутствии катализатора (мелкий раздробленный никель). Продукт взаимодействия — метан — является первым членом ряда предельных углеводородов, состав которых выражается формулой CnH2n+2.
Аналогично углероду кремний тоже образует с водородом соединения, но они менее устойчивы. Надежно идентифицированы только шесть низших гомологов предельного ряда. Их называют силанами. Простейший представитель моносилан SiH4 имеет строение, аналогичное СН4. Силаны - крайне реакционноспособные соединения, воспламеняющиеся на воздухе. Низкая прочность связи Si—Si (DH = -220 кДж/моль) по сравнению со связью С—С (DH = -340 кДж/моль) обусловила возможность образования лишь ограниченного числа силанов по сравнению с углеводородами.
Склонность углерода к образованию полимерных цепей объясняет то обстоятельство, что он в обычных условиях тверд, нелетуч и химически инертен.
При нагревании на воздухе углерод и кремний сгорают с образованием оксидов. Однако процессы окисления идут по-разному. При недостатке кислорода углерод образует оксид углерода (II), а при избытке — оксид углерода (IV). Кремний с кислородом во всех случаях образует оксид кремния (IV). Оксид кремния (II) может быть получен лишь косвенным путем:
Si + SiO2 = 2SiO.
Поиск по сайту: