 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Реальные газы. Уравнение Ван-дер-Ваальса
Поведение реальных газов хорошо удовлетворяет модели идеального газа при уравнении Менделеева-Клапейрона только при малых плотностях. Малые плотности газа реализуются только при малых давлениях и высоких температурах. С ростом давления при постоянной температуре левая часть уравнения должна оставаться постоянной, однако при давлениях порядка в 100 атмосфер наблюдается заметное отклонение от равенства. Для описания поведения газа в широком интервале давлений и температур записывается уравнение Ван-дер-Ваальса:

где
·  — давление,
— давление,
· 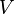 — молярный объём,
— молярный объём,
· 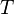 — абсолютная температура,
— абсолютная температура,
·  — универсальная газовая постоянная.
— универсальная газовая постоянная.
Коэффициенты a и b - есть константы Ван-дер-Ваальса, имеющие разные значения для различных газов.
Анализ формулы показывает, что  - есть добавка к внешнему давлению, которое обусловлено взаимным притяжением молекул друг к другу. Их взаимодействие существенно на небольших расстояниях, определяемых R молекулярного действия.
- есть добавка к внешнему давлению, которое обусловлено взаимным притяжением молекул друг к другу. Их взаимодействие существенно на небольших расстояниях, определяемых R молекулярного действия.  =
=  .
.
Коэффициент «b» определяет объём молекул в сосуде.
Внутренняя энергия 1 моля газа: U =  T +
T + 
Уравнение Ван-дер-Ваальса представляет собой уравнение третьей степени относительно объёма. Это уравнение имеет три вещественных корня.
Поиск по сайту: