 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
УСТРОЙСТВО И РАБОТА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Гальванический элемент состоит из двух электродов — анода и катода. Его устройство и принцип работы рассмотрим на примере элемента Даниэля-Якоби. В этом элементе используют медный и цинковый электроды. Каждый электрод помещен в ёмкость с раствором электролита, катионы которых "одноимённы" материалу электрода. Ёмкости разделены перегородкой. Цинковый электрод опущен в раствор ZnSO4. При замыкании цепи гальванического элемента между электродом и раствором электролита идёт реакция окисления:

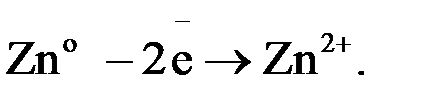
Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны; таким образом цинковая пластинка заряжается отрицательно и становится анодом. Возникает отрицательный электродной потенциал 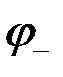 .
.
Между медным электродом и окружающем его раствором CuSO4 идёт реакция восстановления:
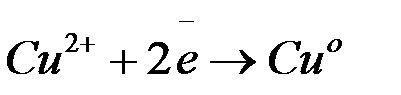
Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом. Электродный потенциал его будет равен 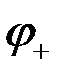 .
.
Ещё раз подчеркну, что в гальваническом элементе окисление — отдача электронов — происходит на аноде (цинковый электрод), восстановление — приобретение электронов- на катоде (медном электроде).
Рекомендуется запомнить правило: окисление происходит на аноде, который заряжается отрицательно, — слова начинаются с гласных "о" и "а", восстановление наблюдается на положительно заряжённом катоде — слова начинаются с согласных "в" и "к".
Процесс на электродах:
(+) 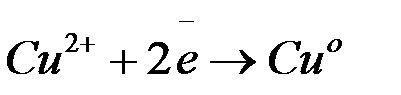
(-) 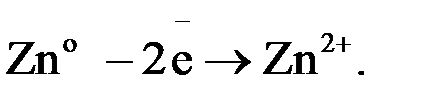
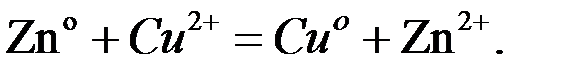 Суммарная окислительно-восстоновительная реакция гальванического элемента.
Суммарная окислительно-восстоновительная реакция гальванического элемента.
Между двумя растворами — сульфата цинка и сульфата меди — находится солевой мостик (СМ). Солевой мостик обычно выполняется в виде трубки, заполненной раствором хлорида калия (КСl) или нитрата аммония (NH4NO3). На границе между насыщенным раствором солевого мостика и растворами электродов ZnSO4 и CuSO4 возникают два диффузионных потенциала, которые близки по абсолютному значению, но противоположны по знаку. Солевой мостик способствует значительному снижению диффузионного потенциала между растворами электролитов.
Характерной особенностью любого гальванического элемента является образование электрохимической цепи — последовательной совокупности всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Электрохимическую цепь медно-цинкового гальванического элемента с учётом возникших скачков потенциалов можно записать следующим образом:
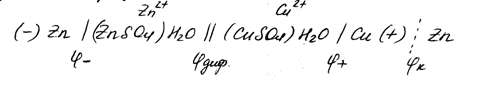 (1)
(1)
Одной вертикальной чертой обозначена граница между металлом и раствором электролита, на которой возникают электродные потенциалы 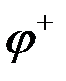 и
и 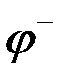 .
.
Двумя чертами обозначена граница между двумя электролитами, проходящая через солевой мостик (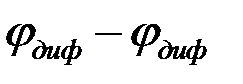 . — диффузионный потенциал на этой границе). Вертикальной пунктирной линией показана граница между двумя металлами; на этой границе возникает контактный потенциал
. — диффузионный потенциал на этой границе). Вертикальной пунктирной линией показана граница между двумя металлами; на этой границе возникает контактный потенциал 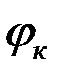 . Солевой мостик позволяет устранить диффузионный потенциал увеличивался бы по мере работы гальванического элемента.
. Солевой мостик позволяет устранить диффузионный потенциал увеличивался бы по мере работы гальванического элемента.
Смысл записи электрической цепи, если её читать слева направо, следующий: анод, т.е цинковый электрод, погружён в раствор ZnSO4, содержащий ионы Zn2+; солевой мостик соединят один раствор электролита с другим, содержанием ионы двух валентной меди; катод, погружённый в раствор CuSO4, при диссоциации которого образуются ионы меди Cu2+. Во внешней цепи электроны перемещаются от анода к катоду (это перемещение показано на рис. стрелкой).
Условие (1) определяет работу гальванического элемента, когда его цепь замкнута. Это условие выполняется в результате присоединения к клеммам гальванического элемента потребляя или измерительных приборов.
Мы знаем, что важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.
Проведём более полное определение: ЭДС — это предельное значение разности потенциалов гальванического элемента, которое наблюдается в условиях равенства нулю тока во внешней цепи и когда устанавливаются все химические и локальные равновесия в фазах и на границы фаз, за исключением границы электрод- электрод.
Применительно к гальваническому элементу Даниэля — Якоби разомкнутая цепь гальванического элемента представлена условием (1) без границе раздела Cu(+)/ Zn, которая обозначена вертикальной пунктирной линией.
В соответствии с условием (1) ЭДС разомкнутого гальванического элемента равна алгебраической сумме скачков потенциалов на границе раздела фаз:
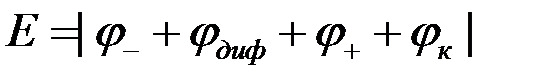
Если пренебречь диффузионным потенциалом (при наличии солевого мостика он ничтожно мал), а контактный потенциал незначителен (или равен нулю после присоединения потребителя), то ЭДС медно-цинкового гальванического элемента будет равна:
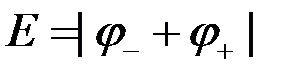 или
или 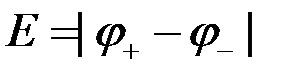
ЭДС является количественной характеристикой работы гальванического элемента — она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую. Принято считать, что величина ЭДС всегда положительна.
Так как абсолютное значение потенциала нельзя измерить, то пользуются значением условного потенциала. Условный потенциал данного электрода — это ЭДС гальванического элемента, состоящего из стандартного водородного электрода (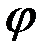 =0) и данного электрода на отрицательном полюсе гальванического элемента всегда идёт процесс окисления, на положительном- восстановления. полюс гальванического элемента определяется только по отношению ко второму электроду. На отрицательном полюсе гальванического элемента всегда идет процесс окисления, на положительном — восстановления. Полюс гальванического элементаопределяется только по отношению ко второму электроду.
=0) и данного электрода на отрицательном полюсе гальванического элемента всегда идёт процесс окисления, на положительном- восстановления. полюс гальванического элемента определяется только по отношению ко второму электроду. На отрицательном полюсе гальванического элемента всегда идет процесс окисления, на положительном — восстановления. Полюс гальванического элементаопределяется только по отношению ко второму электроду.
Поиск по сайту: