 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тема 15. Теория Бора для атома водорода. Спектр атома водорода
Постулаты Бора. Первый постулат: в атоме существуют стационарные (не изменяющиеся со временем) состояния, находясь в которых атом не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, на которых находятся электроны. В стационарном состоянии атома для электрона на круговой орбите значения момента импульса могут принимать только определенный набор дискретных значений, удовлетворяющих условию:
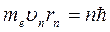 (n = 1, 2, 3, …), где
(n = 1, 2, 3, …), где
me –масса электрона, υn – скорость электрона на n -ой орбите радиуса rn,
n – номер орбиты, ħ = h/2 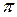 (h – постоянная Планка).
(h – постоянная Планка).
Радиус n -ой орбиты для атома водорода: 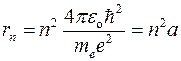 , где
, где
где e – заряд электрона, ε o – электрическая постоянная,
а – радиус первой орбиты (n = 1), называемый первым боровским радиусом.
Второй постулат: при переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) один фотон с энергией hν, равной разности энергий соответствующих стационарных состояний En и Еm:
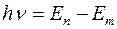 .
.
При переходе атома из состояния большей энергии в состояние меньшей энергии происходит излучение фотона, а при поглощении фотона происходит переход атома из состояния меньшей энергии в состояние большей энергии.
Дискретность набора значений энергии стационарных состояний En и Еm предопределяет дискретность набора возможных частот ν квантовых переходов между этими состояниями, что обусловливает линейчатость спектра атома.
По теории Бора полная энергия электрона на n -ой орбите атома водорода:
 (n = 1, 2, 3, …),
(n = 1, 2, 3, …),
Из приведенной формулы следует, что энергетические состояния атома образуют последовательность уровней, энергия которых изменяется в зависимости от значения числа n, называемое главным квантовым числом. Энергетическое состояние с n = 1 является основным состоянием, а состояния с n >1 являются возбужденными с остояниями.
Согласно второму постулату Бора, при переходе атома водорода из состояния n в состояние т с меньшей энергией испускается фотон с энергией hν:
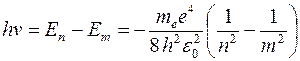 ,
,
откуда частота ν квантового перехода в спектре испускания атома водорода:
 , где R – постоянная Ридберга (
, где R – постоянная Ридберга ( ).
).
Числа m (m = 1, 2, 3 …) и n (n = m + 1, m + 2, m + 3, …) определяют номера электронных орбит в атоме, между которыми происходит квантовый переход.
Приведенная формула описывает серии линий в спектре испускания атома водорода (рис. 31), где m определяет серию (m = 1, 2, 3…), а n определяет отдельные линии соответствующей серии (n = m + 1, m + 2, m + 3, …).
Спектр испускания атома водорода.
В ультрафиолетовой области спектра атома водорода наблюдается
серия Лаймана (m = 1): 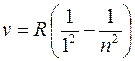 (n = 2, 3, 4, …).
(n = 2, 3, 4, …).
В видимой области спектра атома водорода наблюдается
серия Бальмера (m = 2):  (n = 3, 4, 5, …).
(n = 3, 4, 5, …).
В инфракрасной области спектра атома водорода наблюдаются:
серия Пашена (m = 3):  (n = 4, 5, 6, …);
(n = 4, 5, 6, …);
серия Брэкета (m = 4):  (n = 5, 6, 7, …);
(n = 5, 6, 7, …);
серия Пфунда (m = 5):  (n = 6, 7, 8, …);
(n = 6, 7, 8, …);
серия Хэмфри (m = 6):  (n = 7, 8, 9, …).
(n = 7, 8, 9, …).


Рис. 31.
Таким образом, квантовая теория атома, созданная Бором, позволила описать экспериментально наблюдаемые атомные спектры поглощения и испускания.
Вопросы к экзамену
по второй части двухсеместрового курса физики
(Электричество и магнетизм. Волновая и квантовая оптика)
1. Теорема Остроградского - Гаусса для электростатического поля.
2. Напряженность. Работа сил электростатического поля. Потенциал. Связь между потенциалом и напряженностью электростатического поля.
3. Магнитное поле. Закон Био-Савара-Лапласа. Индукция линейного и кругового тока.
4. Действие магнитного поля на проводник с током (закон Ампера) и на движущийся заряд (сила Лоренца).
5. Магнитный поток. Теорема Гаусса для магнитного поля. Явление электромагнитной индукции.
6. Электромагнитные колебания. Колебательный контур. Уравнение свободных незатухающих гармонических колебаний.
7. Электромагнитные колебания. Колебательный контур. Уравнение свободных затухающих гармонических колебаний.
8. Электромагнитные волны. Вектор Умова-Пойнтинга.
9. Волновая теория света. Интерференция света. Метод Юнга.
10. Дифракция света. Принцип Гюйгенса-Френеля. Метод зон Френеля. Дифракция Френеля на круглом отверстии и на диске.
11. Дифракция света. Дифракция Фраунгофера на дифракционной решетке.
12. Дисперсия и поляризация света. Закон Малюса.
13. Корпускулярная теория света. Фотоэффект и эффект Комптона.
14. Тепловое излучение. Закон Кирхгофа. Закон Стефана-Больцмана. Закон смещения Вина. Квантовая гипотеза Планка.
15. Теория Бора для атома водорода. Постулаты Бора. Спектр атома водорода.
Поиск по сайту: