 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Билет 6. Змінюватися внутрішня енергія термодичнамічної системи може
|
Читайте также: |
1.
 Змінюватися внутрішня енергія термодичнамічної системи може
Змінюватися внутрішня енергія термодичнамічної системи може
тільки в результаті взаємодії системи з іншими тілами (зовнішнім
середовищем). Один із способів зміни внутрішньої енергії – здійснення механічної роботи над системою. Наприклад, всуваючи поршень в циліндр з газом, газ стискаємо (здійснюємо роботу), в результаті температура газу підвищується і змінюється (збільшується) внутрішня енергія газу. Енергію, передавану при цьому термодинамічній системі зовнішніми тілами, називають роботою, що здійснюється над системою.
Перший закон термодинаміки є законом збереження і перетворення
енергії у термодинамічних процесах. Рівняння (2.6) виражає перший закон термодинаміки: теплота, що передається системі, витрачається на зміну її внутрішньої енергії і на здійснення нею роботи проти зовнішніх сил. У разі елементарного процесу перший закон термодинаміки можна записати у вигляді

де dU – нескінченно мала зміна внутрішньої енергії системи; δA –
елементарна робота; δQ – нескінченно мала кількість теплоти. Відмінності в записі dU, δA і δQ пояснюються такими міркуваннями. Внутрішня енергія – однозначна функція стану, тому якщо система повертається в початковий стан, зміна внутрішньої енергії незалежно від шляху переходу дорівнює нулю, тобто умова, що інтеграл по замкненому контуру
2. Співвідно́шення Кла́узіуса — Клапейро́на — рівняння, яке задає закон залежності тиску від температури на кривій співіснування фаз.

де P — тиск, T — температура, Q — прихована теплота, 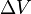 — зміна об'єму речовини при фазовому переході.
— зміна об'єму речовини при фазовому переході.
Формула Клаузіуса — Клапейрона є наслідком рівності хімічних потенціалів різних фаз при фазовому переході.
Якщо q – питома теплота пароутворення (кількість теплоти, яку необхідно затратити для того, щоб перетворити 1 кг рідини в пару при постійній температурі), то qμ = μq – молярна теплота пароутворення; Vμп – молярний об’єм пари, Vμр – молярний об’єм рідини. Тоді залежність тиску насиченої пари рн від температури (рівняння Клапейрона-Клаузіуса) задається співвідношенням:
dpн /dT = qμ/T∙(Vμп – Vμр).
Поиск по сайту: