 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Билет 12. 2.РАУЛЯ ЗАКОН: тиск насиченої пари даного компонента розчину, тобто парціальний тиск пари компонента
|
Читайте также: |
2.РАУЛЯ ЗАКОН: тиск насиченої пари даного компонента розчину, тобто парціальний тиск пари компонента, дорівнює тиску насиченої пари цієї речовини у вільному стані, помноженому на її мольну частку в розчині xі:  (1)
(1)
Для розчинника можна записати  (2)
(2)
Оскільки у бінарному розчині х1 = 1 — х2, то 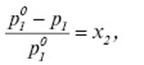 (3)
(3)
тобто відносне зниження тиску насиченої пари розчинника над розведеним бінарним розчином не залежить від природи розчиненої речовини і дорівнює її мольній частці х2.
Якщо другий компонент — нелетка речовина, то p 1 є одночасно і загальним тиском насиченої пари над розчином Pзаг. Розчини, які підпорядковуються Р.з., називаються ідеальними.
∆ Tкип = E·m ,(4)
де Е — ебуліоскопічна стала розчинника.
Для реальних розчинів наведені рівняння Р.з. будуть справедливими при заміні концентрації певною її функцією, яка називається термодинамічною активністю або просто активністю відповідного компонента ai. Напр., рівняння (1) набуває вигляду  (6)
(6)
Вираз (6) називають узагальненим рівнянням Р.з. і може бути застосованим як для ідеальних, так і для реальних розчинів. Величина активності залежить від природи і концентрації всіх компонентів розчину, а також від тиску і температури. Розв’язавши рівняння (6), відносно аі маємо  (7)
(7)
Із виразу (7) випливає, що, по-перше, аі — безрозмірна величина і, по-друге, є відносною активністю, тому що виражена через відношення тиску пари компонента у даному розчині до тиску пари компонента у чистому стані. Такий стан можна вважати стандартним, по відношенню до нього визначається активність і де вона дорівнює одиниці. Такий підхід використовують при вивченні властивостей розчинів неелектролітів.
Поиск по сайту: