 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Вывод по работе
Лабораторная работа №5
Сурьма, висмут.
Цель работы: изучение химических свойств сурьмы и висмута, в том числе: свойства их производных, свойства их солей и тиосоединений.
Опыт 1.
Из солянокислого раствора хлорида сурьмы (III) при помощи минимального количества щелочи получили осадок нерастворимого гидроксида. Щелочь нужна в небольшом количестве, т.к. полученный гидроксид амфотерен и в избытке щёлочи будет растворяться.
SbCl3 + 3NaOH = Sb(OH)3 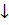 + 3NaCl
+ 3NaCl
Sb3+ + 3OH- = Sb(OH)3 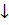
Полученный осадок проверили на растворимость в кислоте и в щелочи. Раствориение произошло в обоих случаях:
Sb(OH)3 + 3NaOH = Na3[Sb(OH)6]
Sb(OH)3 + 3OH- =[Sb(OH)6]3-
Sb(OH)3 + 3HCl = SbCl3 + 3H2O
Sb(OH)3 + 3H+ = Sb3+ + 3H2O
Проделали то же самое с хлоридом висмута (III). Получившийся осадок в щелочи не растворяется.
BiCl3 + 3NaOH = Bi(OH)3 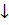 + 3NaCl
+ 3NaCl
Bi3+ + 3OH- = Bi(OH)3 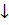
Bi(OH)3 + 3HCl = BiCl3 + 3H2O
Bi(OH)3 + 3H+ = Bi3+ + 3H2O
Bi(OH)3 + 3NaOH – реакция не идёт.
Вывод. Исследовав кислотно-основные свойства испытуемых веществ, установили, что сурьма проявляет амфотерные свойства, в то время как висмут исключительно основные.
Опыт 2.
В концентрированный раствор хлорида сурьмы (III) по каплям добавляли дистиллированную воду до выпадения белого осадка:
SbCl3 + H2O  Sb(OH)Cl2 + HCl
Sb(OH)Cl2 + HCl
Sb(OH)Cl2 + H2O  Sb(OH)2Cl + HCl
Sb(OH)2Cl + HCl
 Sb(OH)2Cl
Sb(OH)2Cl  SbOCl
SbOCl 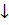 + H2O
+ H2O
Sb3+ + H2O  SbOCl
SbOCl 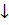 + 2H+
+ 2H+
Либо иногда этот процесс рассматривают как:
[SbCl4]- + H2O  SbOCl
SbOCl 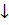 + 2H+ + 3Cl-
+ 2H+ + 3Cl-
Полученный осадок растворим в концентрированной соляной кислоте:
SbOCl 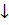 + 2HCl
+ 2HCl  SbCl3 + H2O
SbCl3 + H2O
SbCl3 + HCl  H[SbCl4]
H[SbCl4]
Что вызвано обратным смещением равновесия избытком ионов водорода.
Вывод. При растворении соли сурьмы в воде происходит её ступенчатый гидролиз, а затем отщепление молекулы воды с образованием соли антимонила (стибила) SbO+. Этот процесс обратим.
Опыт 3.
Пропустили через растворы антимонита и антимоната натрия ток сероводорода под тягой. При этом осадки не выпали. Подкислили эти растворы и повторили эксперимент – наблюдалось выпадение оранжевого и красного осадка соответственно.
2NaSbO2 + 3H2S + 2HCl = Sb2S3 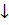 + 2NaCl + 4H2O (оранжевый)
+ 2NaCl + 4H2O (оранжевый)
SbO2- + 3H2S + 2H+ = Sb2S3 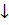 + 4H2O
+ 4H2O
2NaSbO3 + 5H2S + 2HCl = Sb2S5 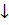 + 2NaCl + 6H2O (тёмно-красный)
+ 2NaCl + 6H2O (тёмно-красный)
SbO3- + 5H2S + 2H+ = Sb2S5 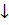 + 6H2O
+ 6H2O
Из уравнений хорошо видно, что в реакции участвуют антимонит и антимонат ионы, а в продуктах ионы сурьмы (III) и (IV). В присутствии ионов водорода осуществляется процесс перехода анионной формы сурьмы в катионную и достижение необходимой концентрации для превышения порога растворимости.
SbO3- + 6H+  Sb3+ + 3H2O (антимонит)
Sb3+ + 3H2O (антимонит)
SbO5- + 10H+  Sb5+ + 5H2O (антимонат)
Sb5+ + 5H2O (антимонат)
Полученные осадки растворимы в сульфиде аммония:
Sb2S3 + 3(NH4)2S = 2(NH4)3SbS3 (тиоантимонит)
Sb2S3 + S2- = 2SbS32-
Sb2S5 + 3(NH4)2S = 2(NH4)3SbS4 (тиоантимонат)
Sb2S5 + S2- = 2SbS42-
При подкислении полученные соли разлагаются:
2(NH4)3SbS3 + 6HCl = Sb2S3 + 6NH4Cl + 3H2S
2SbS32- + 6H+ = Sb2S3 + 3H2S
2(NH4)3SbS4 + 6HCl = Sb2S5 + 6NH4Cl + 3H2S
2SbS42- + 6H+ = Sb2S5 + 3H2S
Вывод. Сурьма образует нерастворимые в воде сульфиды в обоих положительных степенях окисления. Кроме того, она способна к образованию тиосолей: тиоантимоната и тиоантимонита.
Опыт 4.
Через раствор хлорида висмута пропустили ток сероводорода. При этом выпал осадок коричнево-чёрного сульфида.
2BiCl3 + 3H2S = Bi2S3 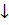 + 6HCl
+ 6HCl
2Bi3+ + 3S2- = Bi2S3 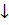
В сульфиде аммония этот осадок не растворяется, следовательно, тиосолей висмут не образует. Это объясняется тем, что исходя из своего положения в ПСХЭ висмут - типичный металл, не склонный к образованию анионов, в то время как сурьма – амфотерный элемент (металлоид). Из вышесказанного следует, что сульфид висмута должен растворяться в концентрированных сильных кислотах, что и наблюдается на деле:
Bi2S3+ 6HCl(конц) = 2BiCl3 + 3H2S (обратный процесс)
Bi2S3 + 6H+ = 2Bi3+ + 3H2S
Вывод. Висмут – типичный металл, не образующий тиосолей. С сероводородом образует нерастворимый в воде сульфид, который легко растворяется в концентрированной соляной кислоте по обменному механизму.
Опыт 5.
В азотнокислый раствор сульфата марганца (II) добавили небольшое количество висмутата натрия, взболтали и дали отстояться. Появилось заметное малиново-фиолетовое окрашивание, характерное для перманганат-ионов.
5NaBiO3 + 2MnSO4 + 16HNO3 = 5Bi(NO3)3 + 2HMnO4 + NaNO3 + 2Na2SO4 + 7H2O
 5 BiO3- + 6H+ + 2
5 BiO3- + 6H+ + 2 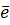 = Bi3+ + 3H2O
= Bi3+ + 3H2O
 2 Mn2+ + 4H2O - 5
2 Mn2+ + 4H2O - 5 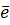 = MnO4- + 8H+
= MnO4- + 8H+
5 BiO3- + 2Mn2+ + 14H+ = 5Bi3+ + 2MnO4- + 7H2O
Вывод. Висмутаты проявляют свойства чрезвычайно сильных окислителей в кислой среде, способных даже окислить марганец до перманганат-иона. Этим ещё раз подтверждается низкая устойчивость соединений висмута (V) как типичного металла.
Опыт 6.
Поочередно прилили висмутат натрия к растворам серной и концентрированной соляной кислоты. В обоих случаях наблюдалось выделение бесцветных газов и обесцвечивание растворов:
2NaBiO3 + 4H2SO4 = Bi2(SO4)3 + Na2SO4 + O2 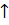
 2 BiO3- + 6H+ + 2
2 BiO3- + 6H+ + 2 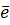 = Bi3+ + 3H2O
= Bi3+ + 3H2O
 1 2 H2O - 4
1 2 H2O - 4 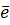 = 4H+ + O2
= 4H+ + O2
2BiO3- + 8H+ 2H2O = 2Bi3+ + 4H2O + O2
NaBiO3 + 6HCl = BiCl3 + NaCl + Cl2 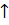 + 3H2O
+ 3H2O
 1 BiO3- + 6H+ + 2
1 BiO3- + 6H+ + 2 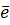 = Bi3+ + 3H2O
= Bi3+ + 3H2O
 1 2Cl- - 2
1 2Cl- - 2 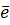 = Cl2
= Cl2
BiO3- + 6H+ +2Cl- = 2Bi3+ + 3H2O + Cl2 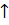
Вывод. Указанные процессы ещё раз подчёркивают, что соединения висмута (V) чрезвычайно сильные окислители, способные окислять даже кислород из воды и хлор из соляной кислоты.
Вывод по работе.
Были исследованы свойства соединений сурьмы и висмута. Показано их кислотно-основное взаимодействие, окислительные превращения, а так же некоторые специфические свойства, связанные с процессом гидролиза и образованием тиосолей.
Поиск по сайту: