 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ 2 КУРСА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА ПО ТЕМЕ «МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ. ПЕРМАНГАНАТОМЕТРИЯ.»
Вопросы для проверки базового (исходного) уровня:
1. Типы окислительно – восстановительных реакций.
2. Сопряженные окислительно – восстановительные пары в окислительно – восстановительных реакциях.
3. Процессы окисления и восстановления.
4. Составление уравнений окислительно-восстановительных реакций электронно–ионным методом.
5. Определение эквивалента окислителя и восстановителя.
| Студент должен знать: 1. Основные понятия окислительно-восстановительных процессов. 2. Окислительно-восстановительные потенциалы редокс-систем. 3. Уравнение Нернста. 4. Методика построения кривых окислительно-восстановительного титрования. 5. Сущность и условия перманганатометрического титрования. 6. Примеры перманганатометрического определения восстановителей. | Литература: Основная: 1. Лекции по аналитической химии. 2. Харитонов Ю.Я. Аналитическая химия М.: Высшая школа, Т. 2. 2000. 5-65с. 3. Васильев В.П. Аналитическая химия. 2 ч. Количественный анализ. М.: Высшая школа, 1989, 3-174с. 4. Васильев В.П. Аналитическая химия. 2 ч. Лабораторный практикум. М.: Дрофа, 2004, 56-64с. 5. Скуг Д., Уэст Д. Основы аналитической химии. М: Мир,1989г. 137-169с. 6. Учебно-методическая разработка к практическому занятию по данной теме Дополнительная: 1. Харитонов, Ю.Я. Примеры и задачи по аналитическая химии. М.: ГЭОТАР – Медиа, 2007, 2. Отто М. Современные методы аналитической химии. в 2-х т. М.: Техносфера. 2004 3. Кристиан Г. Аналитическая химия, в 2 т. М.: БИНОМ Лаборатория, 2009. |
| Студент должен уметь: 1. Составлять уравнения окислительно-восстановительных реакций. 2. Рассчитывать молярные массы эквивалента перманганата калия, пероксида водорода, солей железа(II) в реакциях окисления-восстановления. |
Задания для самостоятельной работы по изучаемой теме:
I.
1. Какие реакции называют окислительно-восстановительными?
2. Дайте определение понятиям: окисление, восстановление, окислитель, восстановитель.
3. Какие из приведенных ниже уравнений реакций являются окислительно-восстановительными?
2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Mn(OH)2 + 2HCl ® MnCl2 + 2H2O
6KI + K2Cr2O7 +7H2SO4 ® 5I2 + 4K2SO4 + Cr2 (SO4)3 + 7H2O
2NaHCO3 ® Na2CO3 + CO2 + H2O
Укажите в них окислитель и восстановитель.
4. Допишите следующие реакции, расставьте в них коэффициенты, используя метод электронно-ионного баланса:
КМnО4 + Н2О2 + H2SO4 ®
KMnO4 + KNO2 + H2SO4 ®
K2Cr2O7 + KNO2 + H2SO4 ®
KMnO4 + FeSO4 + H2SO4 ®
KMnO4 + H2C2O4 + H2SO4 ®
5. Какие титранты-окислители применяются в окислительно-восстановительных методах. Их характеристика и примеры определений с использованием титрантов-окислителей.
6. Какие вещества применяют для установки характеристик раствора KMnO4? Напишите уравнения реакций стандартизации раствора KMnO4.
7. Каковы особенности приготовления стандартного раствора KMnO4 и условия его хранения?
8. Какие процессы протекают в свежеприготовленном растворе перманганата калия?
9. Какие вещества можно определять прямым перманганатометрическим титрованием?
10. От каких факторов зависит реальный потенциал окислительно-восстановительной пары? Напишите уравнения Нернста.
II.
1.Используя метод полуреакций, с оставьте уравнение реакции восстановления перманганат – иона в кислой среде. Как рассчитать эквивалент MnO4- в данном случае?
2. Используя метод полуреакций, с оставьте уравнение реакции восстановления перманганат – иона в нейтральной среде. Как рассчитать эквивалент MnO4- в данном случае?
3. Используя метод полуреакций, с оставьте уравнение реакции восстановления перманганат – иона в щелочной среде. Как рассчитать эквивалент MnO4- в данном случае?
4. Для чего метод перманганатометрии используется в клиническом анализе?
5. Почему раствор перманганата калия нужно хранить в темноте? Приведите соответствующее уравнение реакции.
6. Составьте уравнение реакции взаимодействия перманганата калия с оксалатом натрия в сернокислой среде.
7. Составьте уравнение реакции взаимодействия перманганата калия с сульфатом железа (II) в сернокислой среде.
III. Допишите недостающие составляющие следующих определений:
а) Приготовить титрованный раствор перманганата калия по точной навеске нельзя, так как ….
б) В перманганатометрии реакцию проводят в кислой среде, так как ….
в) Установление нормальности и титра раствора КМnО4 обычно проводят по раствору ….
IV. Составьте три тестовых задания по теме данного занятия по образцу:
Перманганатометрия относится к методам титриметрии, в основе которых лежит реакция:
а) нейтрализации
б) гидролиза;
в) окисления-восстановления;
г) комплексообразования.
V. Ответьте на вопросы тренировочного теста по данной теме:
1). В перманганатометрии используют индикатор:
а) крахмал;
б) КМnО4;
в) лакмус;
г) фенолфталеин.
2). Эквивалент КМnO4 в реакции МnO4-+8Н++5е→Мn2++4Н2О равен:
а) 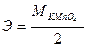 ;
;
б) 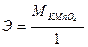 ;
;
в) 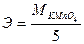 ;
;
г) 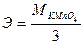 .
.
3). Выберите стандартное вещество для стандартизации титранта KМnО4:
а) K2Сr2O7;
б) СаО;
в) Na2C2O4;
г) Na2CO3.
4). Фактор эквивалентности f окислителя в превращении MnO4- → Mn2+ равен:
а) 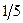 ;
;
б) 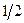 ;
;
в) 1;
г) 1/3.
5). Определить молярную массу эквивалента окислителя (г/моль) в реакции КМnО4 + Н2О2 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
1)31,6;
2)52,67;
3)158;
4)17.
6). Определить молярную массу эквивалента окислителя (г/моль) в реакции КМnО4 + Nа2SО3 + Н2О → MnO2 + K OН + Nа 2SO4
1)31,6;
2)52,67;
3)158;
4)63.
7). Определить молярную массу эквивалента окислителя (г/моль) в реакции КМnО4 + Nа2SО3 +KOH → К2МnО4 + Nа2SО4 + H2O
1)31,6;
2)52,67;
3)158;
4)63.
8). Составить уравнение овр ионно-электронным методом и указать сумму коэффициентов у окислителя и восстановителя KMnО4 + KNО2 + H2SО4 → КNO3 + MnSO4 + K2SO4 + H2O:
1) 5;
2) 7;
3) 10;
4) 2.
9). Укажите анионы, которые не обесцвечивают раствор калия перманганата в сернокислой среде:
А. сульфит–ион;
В. сульфат–ион;
С. нитрит–ион;
Д. ацетат–ион.
10). Укажите анионы, окисляющиеся раствором калия перманганата в сернокислой среде:
А. хлорид–ион;
В. бромид–ион;
С. иодид–ион;
Д. карбонат–ион.
Поиск по сайту: