 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Правила коагуляции
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.
Минимальная концентрация электролита, при которой начинается коагуляция явная или быстрая, называется порогом коагуляции Ск (ϒ)
Иногда вместо порога коагуляции используют величину Vк, называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита:
Vк = 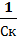
Значит чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
2. Коагулирующим действием обладают не все ионы электролита, а только те ионы, которые несут заряд, противоположный по знаку заряду коллоидной частицы. Таким образом, для дисперсных систем с отрицательно заряженными частицами коагулирующими ионами являются – катионы, а с положительными частицами – анионы.
3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона. Количественно эта закономерность описывается эмпирическим правилам Шульце-Гарди:
ϒ = 
где Z заряд коагулирующего иона.
 или
или 
где  - постоянная для данной системы величина;
- постоянная для данной системы величина;
Z - заряд иона-коагулянта;
 – порог коагуляции одно зарядного, двух зарядного,
– порог коагуляции одно зарядного, двух зарядного,
трех зарядного иона-коагулянта.
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Поэтому коагулирующая способность органических ионов больше по сравнению с неорганическими ионами. Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag+ > Cs+ > Rb+>NH+>K+>Na+>Li+ (этот ряд называется лиотропным)
Поиск по сайту: