 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Свойства элементов, простых тел и их соединений находятся в периодической зависимости от их атомных весов (масс)
Периодическая система элементов явилась обобщением огромного объема экспериментального материала. При этом Менделеев критически осмысливал имеющиеся в его распоряжении данные и, основываясь на только что открытом законе, вносил при необходимости коррективы.
Если в Периодической системе следующий по возрастанию атомного веса элемент не подходил по химическим свойствам, Менделеев оставлял в этом месте пропуск, предполагая, что на его месте должен находиться еще неоткрытый элемент. Уже в первом варианте Периодической таблицы оказалось восемь таких пропусков. Пользуясь методом интерполяции свойств, Менделеев подробно описал свойства трех из них экабора, экаалюминия, экасилиция, по соседству с которыми находились хорошо изученные элементы. Вскоре эти элементы были открыты и получили, соответственно, названия скандий, галлий, германий. Их свойства с большой точностью совпали с предсказанными Менделеевым, что можно показать на примере германия (табл. 6.1).
Успех сформулированного Менделеевым периодического закона и таблицы элементов получил признание и способствовал заметному развитию химической науки. Лишь позднее спустя 30-50 лет он получил физическое осмысление с развитием квантовой механики.
§ 2. Физическое обоснование Периодического закона. Открытие Д.И. Менделеева – пример гениального эмпирического обобщения. Причины периодического изменения свойств элементов не были им указаны, да этого и не могло быть при тогдашнем уровне развития науки, т.к. еще не имелось никаких данных о внутреннем строении атома. Как известно, Резерфорд, предложив планетарную модель атома, сумел установить, что заряд ядра в элементарных зарядах составляет примерно половину его атомной массы.
Более точно заряды атомных ядер могут быть определены по рентгеновским спектрам элементов. Впервые эти исследования провел Мозли (1912 г.). Оказалось, что частота испускаемого рентгеновского излучения пропорциональна квадрату заряда ядра: n = c(Z–b)2, где b, c – эмпирические постоянные, одинаковые для всех атомов, но разные для разных линий рентгеновского спектра. Таким образом, заряд ядра (количество электронов в атоме) совпадает с порядковым номером элемента в Периодической системе. Поэтому современная формулировка Периодического закона следующая: Свойства атомов элементов, образованных ими простых и сложных веществ, находятся в периодической зависимости от заряда их ядер или порядкового номера в таблице Менделеева.
Таблица 6.1
Предсказания Менделеева о свойствах элемента экасицилия (германия)
| Свойства элементов и их соединений | Кремний (Si) и его соединения | Предсказанные Менделеевым свойства экасилиция (Es) | Германий (Ge) и его соединения | Олово (Sn) и его соединения |
| Относительная атомная масса | 72,6 | |||
| Внешний вид | серый, алмазоподобный | серый металл | серый металл | белый металл или серый неметалл |
| Температура плавления, °С | Высокая | |||
| Плотность, г/см3 | 2,32 | 5,5 | 5,36 | 7,28 или 5,75 |
| Взаимодействие с кислотами и щелочами | устойчив к кислотам, медленно реагирует со щелочами | устойчив к кислотам и щелочам | не взаимодействует с HCl и NaOH, реагирует с HNO3 | медленно реагирует с конц. HCl, реагирует с HNO3, не реагирует с NaOH |
| Формула оксида и его плотность, г/см3 | SiO2, 2,65 | EsO2, 4,7 | GeO2, 4,70 | SnO2, 7,0 |
| Формула хлорида | SiCl4 | EsCl4 | GeCl4 | SnCl4 |
| Температура кипения хлорида, °С | 57,6 | |||
| Плотность хлорида, г/см3 | 1,50 | 1,9 | 1,88 | 2,23 |
Наконец, с открытием электронного строения атомов (30-40 гг. 20 в.), стала ясна глубокая физическая сущность Периодического закона и таблицы Менделеева – свойства и положение элементов зависит от периодичности электронного строения атомов. Благодаря тому, что определены заряды ядер всех известных элементов, можно гарантировать, что между элементом №1 и элементом №110 не может находиться неизвестных элементов.
§ 3. Структура Периодической системы. Периоды, ряды, группы, подгруппы. Существует несколько форм графического изображения Периодической системы. Наиболее распространенной является так называемая короткопериодная форма. В Периодической системе выделяют отдельные периоды, ряды, группы, подгруппы.
Периодом называется последовательность элементов, расположенных по возрастанию их атомных номеров, начинающаяся щелочным металлом (первый период – водородом) и заканчивается инертным газом. Номер периода соответствует главному квантовому числу n самой внешней электронной оболочки. Сейчас известно 7 периодов, из которых последний, седьмой, заполнен не целиком. Периоды делятся на малые (1-3), состоящие из одного ряда, и большие (4-7), состоящие из двух рядов. В пределах периода происходит закономерное изменение химических свойств элементов.
Группа элементов – это совокупность элементов с аналогичным электронным строением и, как следствие, с похожими химическими свойствами. Группы делятся на две подгруппы: главную и побочную. В главную подгруппу входят элементы и малых, и больших периодов, в побочную – только больших. Всего в Периодической системе 8 групп.
Другой формой представления Периодической системы является длиннопериодная. В ней особенно хорошо проявляется деление химических элементов на семейства, которые выделяются по принципу заполнения того или иного электронного подуровня: s-, p-, d- и f-элементы.
s-элементы сосредоточены в начале периодов (первый период содержит только s-элементы), общая формула электронного строения ns1-2. К s-элементам относятся самые активные металлы – щелочные и щелочноземельные.
p-элементы находятся в конце периодов (кроме первого), общая формула электронного строения ns2np1-6. p-элементы более разнообразны по своим физическим и химическим свойствам.
d-элементы появляются только в больших периодах, занимая промежуточное положение между s- и р-элементами, поэтому они также называются переходными элементами или переходными металлами. Общая формула электронного строения (n-1)d1-10ns0-2. По физическим свойствам это типичные металлы.
f-элементы появляются в периодах, начиная с шестого. Их общая формула электронного строения (n-2)f1-14(n-1)d0-1ns2. Так как у них происходит заполнение третьего снаружи электронного подуровня, а внешние электронные оболочки остаются неизменными, то их химические свойства очень похожи. Поэтому все эти элементы должны занимать одну клетку в побочной подгруппе третьей группы. В Периодической системе они вынесены в отдельные строки, называемые лантанидами и актинидами по первым элементам этих рядов – лантану и актинию.
Следует обратить особое внимание на место водорода в Периодической системе. С одной стороны, электронное строение 1s1 подобно строению атомов главной подгруппы I группы (щелочных металлов). Особенно яркое сходство свойственно спектрам этих атомов. С другой стороны, атому водорода не хватает только одного электрона до конфигурации ближайшего инертного газа, и в этом он подобен галогенам – элементам главной подгруппы VII группы. Кроме того, гидрид-ион H– во многом похож на галогенид-ионы F–, Cl–, Br–. Поэтому водород – единственный элемент, имеющий два места в Периодической системе – в I и VII группах. Сейчас большинство ученых считает, что основное место водорода – в VII группе. Аналогия в реакциях водорода и щелочных металлов наиболее полно проявляется в водных растворах, где существенное влияние оказывает гидратация ионов. Кроме того, ион H+ имеет вакантную электронную оболочку и тем самым принципиально отличается от всех остальных элементов. Простое вещество водород по своим физическим свойствам хорошо ложится в ряд галогенов и выпадает из ряда щелочных металлов. Обычно электронная формула элемента записывается для валентных электронов. Несколько более подробного рассмотрения заслуживает аналогия между элементами главных и побочных подгрупп. Сделаем это на примере элементов VI группы:
| S0 | ... 2 s 22 p 6 3 s 23 p 4 | Se0 | ... 3 s 23 p 63 d 10 4 s 24 p 4 | Cr0 | ... 3 s 23 p 6 3 d 54 s 1 |
| S2– | ... 2 s 22 p 6 3 s 23 p 6 | Se2– | ... 3 s 23 p 63 d 10 4 s 24 p 6 | — | |
| S4+ | ... 2 s 22 p 6 3 s 2 | Se4+ | ... 3 s 23 p 63 d 10 4 s 2 | Cr4+ | ... 3 s 23 p 6 3 d 2 |
| S6+ | ... 2 s 22 p 6 | Se6+ | ... 3 s 23 p 63 d 10 | Cr6+ | ... 3 s 23 p 6 |
Таким образом, элементы побочных подгрупп, отличаясь в электронном строении во всех степенях окисления, становятся подобными типическим элементам в высшей положительной степени окисления.
§ 4. Закономерности периодичности свойств химических элементов и соединений. Периодичность фундаментальных параметров атомов хорошо иллюстрируются рис. 6.1, 6.2.
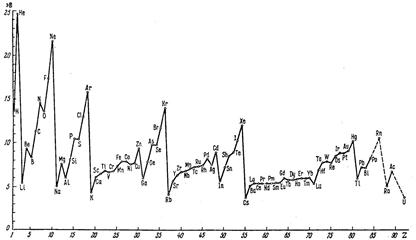
Рис. 6.1. Зависимость энергии ионизации атомов от атомного номера элемента.

Рис. 6.2. Зависимость орбитальных радиусов атомов от атомного номера элемента.
На начало III тысячелетия открыто 114 элементов, но IUPAC утвердило названия для 104 – резерфордий, 105 – дубний, 106 – сиборгий, 107 – борий, 108 – хассий, 109 – мейтнерий, 110 – дармштадтий.

|
Лекция 7, 8
Поиск по сайту: