 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Распределение молекул идеального газа по скоростям
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv. Для вывода функции распределения молекул по скоростям f(v) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv. 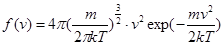 , где
, где 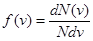 - функция распределения,
- функция распределения, 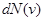 - число молекул, скорости которых лежат в интервале от v до v + dv, N- общее число молекул газа, m – масса одной молекулы, T – абсолютная температура, k = 1,38*10-23Дж/К – постоянная Больцмана.
- число молекул, скорости которых лежат в интервале от v до v + dv, N- общее число молекул газа, m – масса одной молекулы, T – абсолютная температура, k = 1,38*10-23Дж/К – постоянная Больцмана.
Наиболее вероятная скорость vв — скорость, при которой f(v) максимальна.
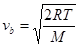 , где M — молярная масса газа, R = 8,31 Дж/(моль×К) общая газовая постоянная.
, где M — молярная масса газа, R = 8,31 Дж/(моль×К) общая газовая постоянная.
Средняя скорость молекул газа 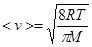 .
.
Средняя квадратичная скорость молекул газа 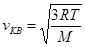
Поиск по сайту: