 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Идеальный газ. Основное уравнение молекулярно-кинетической теории
Молекулярная физика
Основные понятия
Количество вещества измеряется в молях (n).
n - число молей
1 моль равен количеству вещества системы, содержащей столько же частиц, сколько атомов содержится в 0,012 кг углерода 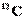 . Число молекул в одном моле вещества численно равно постоянной Авогадро NA.
. Число молекул в одном моле вещества численно равно постоянной Авогадро NA.
М – молярная масса (масса моля) – величина, равная отношению массы вещества m к количеству вещества n:
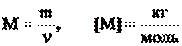
mo – масса одной молекулы, m – масса взятого количества вещества
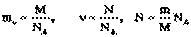 - число молекул в данном объеме.
- число молекул в данном объеме.
Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Основным уравнением молекулярно-кинетической теории газа является уравнение:
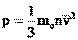 ,
,
р – давление газа на стенки сосуда,
n – концентрация молекул,
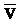 - средняя квадратичная скорость движения молекул.
- средняя квадратичная скорость движения молекул.
Давление газа р можно определить по формулам:
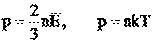 ,
,
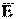 - средняя кинетическая энергия поступательного движения молекул,
- средняя кинетическая энергия поступательного движения молекул,
Т – абсолютная температура,
K=1,38 10-23 Дж/К – постоянная Больцмана.
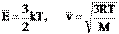 ,
,
где 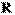 =8,31 Дж/моль × К, R – универсальная газовая постоянная
=8,31 Дж/моль × К, R – универсальная газовая постоянная
Т=373+to С, to С – температура по Цельсию.
Смесь газов
Если в объеме V находится не один газ, а смесь газов, то давление газа р определяется законом Дальтона: смесь газов оказывает на стенки давление, равное сумме давлений каждого из газов, взятых в отдельности:
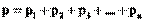 ,
,
Поиск по сайту: