 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
МКТ ИДЕАЛЬНОГО ГАЗА
Идеальный газ – газ, взаимодействие между молекулами которого пренебрежимо мало.
Основное уравнение МКТ идеального газа:  где
где  давление газа (обусловлено ударами молекул газа о стенки сосуда и помещенное в газ тело);
давление газа (обусловлено ударами молекул газа о стенки сосуда и помещенное в газ тело); 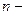 концентрация (число частиц в единице объема)
концентрация (число частиц в единице объема) 
 среднее значение квадрата скорости.
среднее значение квадрата скорости.  средняя квадратичная скорость. Если учесть, что
средняя квадратичная скорость. Если учесть, что  средняя кинетическая энергия поступательного движения молекулы, то основное уравнение МКТ идеального газа можно написать в виде:
средняя кинетическая энергия поступательного движения молекулы, то основное уравнение МКТ идеального газа можно написать в виде:  связь давления со средней кинетической энергией поступательного движения молекулы.
связь давления со средней кинетической энергией поступательного движения молекулы.
Абсолютная шкала температур – шкала, по которой температура измеряется от абсолютного нуля, а каждый градус этой шкалы равен градусу по шкале Цельсия. Абсолютный нуль – это температура, при которой прекратилось бы тепловое движение молекул, абсолютный нуль не достижим. Связь абсолютной температуры  с температурой по шкале Цельсия
с температурой по шкале Цельсия 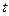 :
: 
 .
.
С точки зрения МКТ абсолютная температура – это мера средней кинетической энергии поступательного движения молекул газа:  где
где  постоянная Больцмана,
постоянная Больцмана,  При одинаковой температуре средняя кинетическая энергия поступательного движения молекул всех газов одинакова.
При одинаковой температуре средняя кинетическая энергия поступательного движения молекул всех газов одинакова.
Используя последнюю формулу и формулу связи давления и средней кинетической энергии поступательного движения молекулы, можно получить связь между давлением и абсолютной температурой: 
Состояние газа можно описать с помощью макроскопических параметров – давления, температуры, объема. Уравнения, связывающие эти величины, называются уравнения состояния:
1) Уравнение Менделеева – Клапейрона: 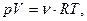 где
где 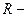 универсальная газовая постоянная,
универсальная газовая постоянная, 
2) Уравнение Клапейрона:  или
или  Уравнение можно использовать в том случае, если масса газа не изменяется.
Уравнение можно использовать в том случае, если масса газа не изменяется.
Процессы, происходящие с данной массой газа при неизменном значении одного из параметров, называются изопроцессами. Математические соотношения между двумя изменяющимися параметрами называются газовыми законами, их легко получить, например, из уравнения Клапейрона.
| Изопроцессы | Перемен-ные параметры | Газовые законы | Графики | ||
Изотермический процесс 
| 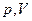
|  или или  , зависимость между , зависимость между 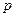 и и  обратно пропорциональная обратно пропорциональная
|
  
| ||
Изобарный процесс 
| 
|  или или  , зависимость между , зависимость между  и и  прямо пропорциональная прямо пропорциональная
|  
| ||
Изохорный процесс 
| 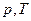
|  или или  ,зависи-мость между ,зависи-мость между 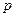 и и  прямо пропорциональная прямо пропорциональная
|  изохоры
изохоры
|
Содержание
Поиск по сайту: