 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
D – элементы
Медь. Элемент одиннадцатой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
Оксид меди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита чёрного цвета.
Получить оксид меди(II) можно:
· нагревая металлическую медь на воздухе (при температурах ниже 1100 °C получается оксид меди(II):
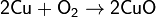
· нагревая гидроксид меди(II), её нитрат или карбонат:



Гидроксид меди(II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество с ромбической кристаллической решеткой (а = 0,2949 нм, b = 1,059 нм, с = 0,5256 нм, z = 4). Cu(ОН)2 практически не растворим в воде. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водныхсуспензий разлагается до CuО и Н2О.


Соли.Фосфаты меди(II) — неорганические соединения, соли металла меди и фосфорной кислоты.
Метафосфат меди(II) Cu(PO3)2•4H2O — синие кристаллы, образуются при осаждении этанолом смеси растворов хлорида меди(II) иметафосфата натрия:

Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белкомцерулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белкагемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Цинк. Элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементовД. И. Менделеева, с атомным номером 30. Обозначается символом Zn. Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Оксиды. Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное легирование кислородом делает его полупроводником n-типа.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю.
Оксид цинка амфотерен — реагирует с кислотами с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (Na2[Zn(OH)4], Ba2[Zn(OH)6]):
[Zn(OH)3]- + OH-  [Zn(OH)4]2-
[Zn(OH)4]2-
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
ZnO + 4NH3 + Н2О — [Zn(NH3)4](OH)2
При сплавлении с щелочами и оксидами металлов оксид цинка образует цинкаты:
ZnO + 2NaOH  Na2ZnO2 + H2O
Na2ZnO2 + H2O
ZnO + CoO  CoZnO2
CoZnO2
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и силикаты:
ZnO + B2O3  Zn(BO2)2
Zn(BO2)2
ZnO + SiO2  ZnSiO3
ZnSiO3
Гидроксиды. Гидроксид цинка при стандартных условиях представляет собой бесцветные кристаллы, является аморфным веществом. В настоящее время известно 5 полиморфных модификаций, из которых устойчивой является только модификация с ромбической сингонией. Гидроксид цинка практически нерастворим в воде, проявляет амфотерные свойства (с преобладанием основных).
Взаимодействие растворимых солей цинка с щелочами:

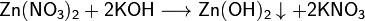
Кислоты. Хлорид цинка (хлористый цинк, дихлорид цинка, паяльная кислота) — химическое соединение цинка с хлором, имеющее формулу ZnCl2.Белые гигроскопичные кристаллы.
Получение:
1) растворение цинка или его окиси в соляной кислоте с последующим выпариванием растворов.
2) нагревание жидкого цинка в токе хлора.
Соли. Ортофосфат цинка — неорганическое соединение, соль металла цинка и ортофосфорной кислоты с формулой Zn3(PO4)2, бесцветные кристаллы, не растворяется в воде, образует кристаллогидрат.
Обработка растворов солей цинка гидрофосфатом натрия:

Поиск по сайту: