 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Вопрос№25 Агрегатное состояние вещества. Насыщенный и ненасыщенный пар
Испарение, конденсация, преобразование энергии при этих процессах
Рис. 1
Агрегатные состояния – это состояния одного и того же вещества, переходы между которыми сопровождаются скачкообразным изменением плотности и других физических характеристик (рис. 1). Обычно выделяют три агрегатных состояния вещества: твердое, жидкое и газообразное. Можно получить и ионизованную плазму, которую часто считают четвертым состоянием вещества.
Испарение – это переход вещества из жидкого состояния в газообразное, т.е. образование пара, происходящее со свободной поверхности жидкости (рис. 2). Вследствие теплового движения молекул испарение возможно при любой температуре. При этом с поверхности жидкости вылетают наиболее быстрые молекулы. Их кинетическая энергия превышает работу сил молекулярного сцепления жидкости. В процессе испарения жидкость охлаждается, поскольку средняя кинетическая энергия молекул, оставшихся в жидкости, понижается.
Скорость испарения зависит от типа жидкости. Она увеличивается с возрастанием температуры жидкости и площади ее свободной поверхности, а также при наличии ветра, который уносит вылетевшие из жидкости молекулы, не давая им вернуться обратно в жидкость.
Конденсация – это переход вещества из газообразного состояния в жидкое (конденсированное), например, пара в жидкость. Конденсация может наблюдаться при охлаждении или сжатии газа.
Удельная теплота парообразования – это скалярная физическая величина, численно равная количеству теплоты, которое необходимо для превращения жидкости массой 1 кг в пар при постоянной температуре. Единицей удельной теплоты парообразования в СИ является Дж/кг. Удельная теплота парообразования r заносится в справочные таблицы. Таким образом, для перевода жидкости массой m в пар требуется количество теплоты
Q = rm
При конденсации определенной массы вещества выделяется такое же количество теплоты, которое поглощается при испарении той же массы.
Насыщенный и ненасыщенный пар
Если сжимать газ в сосуде при постоянной температуре, то при некотором его объеме в сосуде появится жидкость и перестанет меняться давление, так как концентрация молекул над жидкостью станет постоянной за счет наступления динамического равновесия между жидкостью и паром. При дальнейшем уменьшении объема газа поршень коснется жидкости и давление резко возрастет.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным. Под динамическим равновесием жидкости и пара понимают такое их состояние, когда число молекул, покидающих поверхность жидкости, равно в среднем числу молекул пара, возвращающихся за то же время в жидкость. Название «насыщенный» подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
Зависимость давления насыщенного пара от температуры
Если в замкнутом сосуде нагревается жидкость, то с ростом температуры в пространстве над жидкостью растет концентрация молекул n и их средняя энергия  , поэтому давление
, поэтому давление  растет нелинейно (рис. 3).
растет нелинейно (рис. 3).
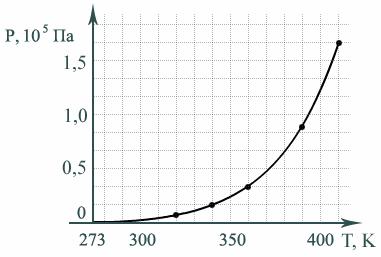
Рис. 3
Когда вся жидкость в сосуде превратится в пар, то давление начнет расти прямо пропорционально температуре T, как давление идеального газа.
Кипение. Температура кипения
Кипение – это процесс интенсивного парообразования, происходящий как со свободной поверхности жидкости, так и по всему объему жидкости внутрь образующихся в ней пузырьков пара.
Кипение начинается при температуре, когда давление насыщенного пара внутри мельчайших пузырьков воздуха, которые всегда имеются внутри жидкости, начинает превышать давление вокруг этих пузырьков. Оно равно сумме атмосферного и гидростатического давлений. При этом пузырьки начинают расти. Из-за этого растет и архимедова (выталкивающая) сила, которая поднимает их вверх, где они лопаются, выбрасывая пар. При заданном давлении над кипящей жидкостью температура системы «жидкость–пар» постоянна для данного вещества (см. Справочные таблицы) и называется температурой кипения. На кривой нагревания жидкости при постоянной подводимой мощности участок кипения будет представлен как плато (рис. 4).
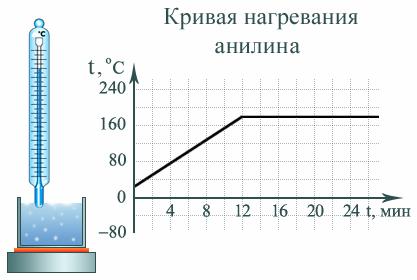
Рис. 4
Пока вся жидкость в сосуде не выкипит, температура жидкости постоянна.
Температура кипения повышается с ростом внешнего давления по закону изменения давления насыщенного пара от температуры (рис. 3). Нужно просто построить график обратной функции T (p), так как обычно при кипении давлением столба жидкости можно пренебречь по сравнению с давлением газа над жидкостью.
Влажность воздуха
Физическая величина, характеризующая содержание в воздухе водяного пара, называется влажностью воздуха. Относительная влажность воздуха – это отношение парциального давления (или концентрации молекул) водяного пара, содержащегося в воздухе при данной температуре, к давлению (концентрации) насыщенного пара при той же температуре. Выражается:

Относительная влажность воздуха показывает, насколько водяной пар в данных условиях близок к насыщению. Именно от этого зависит интенсивность испарения воды и потеря влаги живыми организмами. Для человека наиболее благоприятна относительная влажность, равная 40–60%.
Измерение влажности
Для измерения влажности используют зависимость различных параметров веществ от влажности воздуха. Такими параметрами могут служить, например, скорость испарения воды (психрометр, рис. 5), температура выпадения росы при локальном охлаждении воздуха(гигрометр, рис. 6), удлинение волоса при заданной нагрузке (волосяной гигрометр), сопротивление полупроводников (электронный измеритель влажности).
С помощью гигрометра измеряют точку росы – температуру, до которой необходимо охладить воздух, чтобы содержащийся в нем водяной пар, остывая, стал насыщенным. Начиная с этой температуры, охлаждение воздуха сопровождается появлением капелек росы на зеркальном сосуде, температуру которого понижают, прокачивая грушей воздух через легкокипящую жидкость (рис. 6).
С помощью психрометра фиксируют разницу температур двух термометров – сухого и влажного (рис. 5). По этой разнице и температуре сухого термометра устанавливают влажность воздуха по психрометрической таблице.
Кристаллические и аморфные твердые тела
Кристалл – это твердое тело, обладающее трехмерной периодической атомно–молекулярной структурой. Обычно имеет форму правильного симметричного многогранника. Крупные одиночные кристаллы называются монокристаллами. Агрегат мелких монокристаллов различной ориентации (кристаллических зерен) называется поликристаллом. Большинство твердых тел (минералы, металлы и др.) имеют поликристаллическое строение. Отличительными особенностями кристаллических веществ являются анизотропия монокристаллов и наличие четкой температуры плавления (как для моно-, так и для поликристаллов).
Встречается и некристаллическое твердое состояние вещества, например аморфное.
Анизотропия свойств кристаллов
Зависимость физических свойств твердого тела от направления внутри него называется анизотропией. Все монокристаллы анизотропны (по разным направлениям в кристалле различны механическая прочность, теплопроводность, электропроводность и др.).Поликристаллические материалы, состоящие из огромного числа случайно ориентированных мелких монокристаллов, в обычных условиях изотропны. Изотропны и аморфные тела.
Плавление и кристаллизация, температура плавления
Переход вещества из кристаллического твердого состояния в жидкое называется плавлением. При плавлении кристаллического тела температура системы «жидкость–кристалл» не меняется и называется температурой плавления (рис. 7).
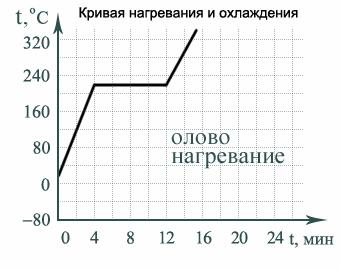
Рис. 7
Процесс образования кристаллов из веществ, находящихся в жидком (или аморфном) состоянии, называется кристаллизацией. Во время кристаллизации упорядочивается движение частиц вещества, которое постепенно преобразуется в тепловые колебания около некоторых средних положений равновесия – узлов кристаллической решетки. Для любой химически чистой жидкости этот процесс идет при постоянной температуре – температуре кристаллизации, которая совпадает с температурой плавления данного кристалла.
Изменение внутренней энергии при плавлении и кристаллизации
При плавлении кристаллов происходит разрушение кристаллической решетки, что требует передачи телу определенного количества энергии:
Q = lm,
где l – удельная теплота плавления вещества, m – масса расплавившегося тела.
Кристаллизация сопровождается выделением определенного количества теплоты, которое равно количеству теплоты, затраченному на плавление такой же массы кристаллического вещества при переводе его в жидкое состояние.
Поиск по сайту: