 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
У МИКРООРГАНИЗМОВ
_____________________________________________________
1. Индукция синтеза ферментов
2. Репрессия синтеза ферментов
3. Регуляция активности ферментов
В клетках микроорганизмов все разнообразие обменных процессов строго регулируется. Эффективность клеточных регуляторных механизмов чрезвычайно высока. Именно они обеспечивают максимально эффективное использование питательных веществ из среды, предупреждают излишнему синтезу промежуточных и конечных метаболитов, отвечают за высокую адаптацию к изменениям окружающей среды.
Поскольку практически все реакции в клетке активируются ферментами, регуляция метаболизма является регуляцией интенсивности ферментных реакций. Скорость ферментативных реакций может обеспечиваться двумя путями:
1) изменением количества ферментов;
2) изменением их активности.
Конститутивные ферменты синтезируются постоянно независимо от условий окружающей среды. Образование ферментов катаболизма регулируется путем индукции.
Индуцибельные ферменты синтезируются только тогда, когда в среде присутствуют субстраты, в расщеплении которых они принимают участие.
Образование ферментов анаболизма регулируется путем репрессии. Механизм угнетения синтеза ферментов называют репрессией конечным продуктом.
Второй тип регуляции – регуляция на уровне активности ферментов – присущ ключевым ферментам метаболизма.
Оба типа регуляции метаболизма приводят к изменению скорости протекания реакции. Однако, если индукция и репрессия действуют медленно, то изменение активности ключевого фермента проявляется мгновенно.
Индукция синтеза ферментов. Индуцибельные ферменты синтезируются лишь тогда, когда в среде присутствуют соответствующие субстраты.
Наиболее детально изучена индукция синтеза β-галактозидазы у E. coli. Фермент осуществляет гидролиз лактозы:
 Лактоза β-галактозидаза D -глюкоза + D –галактоза.
Лактоза β-галактозидаза D -глюкоза + D –галактоза.
Клетки E. coli, растущие на среде с глюкозой, содержат следовое количество β-галактозидазы. При добавлении в среду лактозы β-галактозидазная активность возрастает в 1000 раз. Содержание фермента может достичь 3% от общего клеточного белка.
Если использование субстрата идет через серию ферментативных реакций:





 А а В в С с Д д Е е К,
А а В в С с Д д Е е К,
то возможно несколько типов индукции:
1) субстрат А индуцирует образование всех ферментов (а, в, с, д, е). Такой механизм называется координированной индукцией;
2) синтез отдельных ферментов может происходить поэтапно или последовательно. При этом каждый отдельный фермент индуцируется продуктом предыдущей реакции. Такой механизм получил название последовательной индукцией;
3) ферменты начальных реакций (а, в, с) индуцируются субстратом индуктором А, индукция остальных ферментов (д, е) осуществляется последовательно продуктами Д и Е. Это – смешанный тип индукции.
Лактозный оперон E. coli, состоящий из трех структурных генов (z, y, a), промотора (Р) и оператора (О), был первой системой, на которой Ж. Моно и Ф. Жакоб изучили механизм индукции синтеза ферментов. Согласно с их моделью, в молекуле ДНК рядом со структурными генами и геном-оператором находится ген-регулятор (рис. 6).
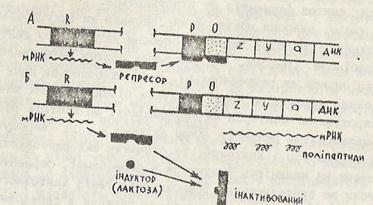
Рис. 6 – Схема индукции синтеза фермента катаболизма лактозы (β-галактозидазы):
А – индуктор отсутствует. Продукт гена-регулятора взаимодействует с оператором, транскрипции структурных генов не происходит;
В – индуктор присутствует. Взаимодействие индуктора с репрессором инактивирует его. Репрессор не взаимодействует с оператором, структурные гены транскрибируются, т.е. идет синтез фермента.
Он контролирует синтез белка-репрессора некаталитического аллостерического белка. Репрессор имеет два активных участка: одним он взаимодействует с оператором, а другим – с индуктором.
При отсутствии лактозы молекула репрессора связывается с оператором и ингибирует транскрипцию структурных генов. Когда в клетку проникает лактоза, она связывается с репрессором и в результате этого образуется неактивный комплекс репрессора с индуктором. Он не может взаимодействовать с оператором и мешать транскрипции структурных генов. Вследствие этого, индуцируется синтез ферментов катаболизма лактозы. При исчерпании индуктора репрессор снова переходит в активное состояние, связывается с оператором и блокирует транскрипцию структурных генов.
Репрессия синтеза ферментов. При репрессии синтеза ферментов молекула репрессора неактивна и не может связываться с оператором. Для того, чтобы репрессор (апорепрессор) заблокировал работу оператора, он должен активироваться конечным продуктом биосинтеза (корепрессором). При взаимодействии корепрессора с апорепрессором в последнем происходят конформационные изменения, он приобретает высокое родство с оператором и блокирует его. Вследствие этого транскрипция структурных генов оперона прекращается, синтез фермента останавливается.
Таким образом, опероны могут функционировать как индуцибельные, так и репрессибельные. примером первых является оперон катаболизма лактозы. Опероны, регулирующие синтез аминокислот, нуклеотидов, функционируют как репрессибельные. Они включаются лишь тогда, когда в среде отсутствуют конечные продукты биосинтеза.
При выращивании бактерий на средах, содержащих разные сахара, имеет место катаболическая репрессия. Если клетки выращивать на среде с глюкозой и лактозой, то сначала используется глюкоза Несмотря на наличие индуктора в среде, ферменты катаболизма лактозы не синтезируюся. Транскрипция генов лактозного оперона начинается только поле снижения уровня глюкозы в среде.
Регуляция активности ферментов. Более быстрая реакция в ответ на резкие изменения условий окружающей среды осуществляется путем изменения каталитической активности ферментов. Этот механизм получил название ингибирования конечным продуктом (ретроингибирование). Регуляциям такого типа подвержены аллостерические ферменты, занимающие ключевые позиции в биосинтетических цепях. Они имеют два центра: каталитический (активный), к которому присоединяется субстрат, и регуляторный (аллостерический). Последний отличается от активного местом расположения и конфигурацией. Вещества, оказывающие влияние на активный центр, называются эффекторами. Если они повышают активность фермента, их называют активаторами, если снижают – ингибиторами. Активатором чаще бывает субстрат данного фермента, ингибитором – продукт реакции.
Регуляторное влияние активатора на аллостерический фермент осуществляется на уровне образования фермент-субтратного комплекса (рис. 7).

Рис. 7– Регулирование активности аллостерического фермента
Активность некоторых ферментов регулируется путем химической модификации их молекул. В основе этого механизма лежит ковалентное обратимое связываниес ферментом определенных химических групп.
Вопросы для самоконтроля:
1. Чем отличаются индуцибельные ферменты от конститутивных?
2. Какими путями осуществляется регуляция скорости ферментативных реакций?
3. Как осуществляется индукция синтеза ферментов?
4. Объясните механизм репрессии синтеза ферментов.
5. Опишите основные способы регуляции активности ферментов.
6. Какие ферменты называются аллостерическими?
Поиск по сайту: