 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XIV.2. Термодинаміка електрохімічних систем
З двох напівелементів одержують найпростіший електрохімічний ланцюг (гальванічний елемент) (рис. 76). ЕРС гальванічного елемента складається з алгебраїчної суми стрибків потенціалу на межах всіх різнорідних фаз такої системи (М1│ Ел1; Ел1│Ел2; М2│Ел2; М1│М2).
Стрибок потенціалу на межі метал – розчин електроліту є наслідком переходу заряджених частинок через поверхню розділу фаз. При такому переході, окрім хімічної роботи, здійснюється і електрична робота. Відповідно стан зарядженої фази в розрахунку на 1 моль компонента і характеризується так званим електрохімічним потенціалом  :
:
 , (XIV.2.1)
, (XIV.2.1)
 де
де  - звичайний хімічний потенціал і – того компоненту даної фази, zFФі – електрична енергія 1 моль заряджених частинок цього компонента в даній фазі, F – число Фарадея, тобто сумарний заряд 1 моль-екв. іонів, що несуть заряд z, Фі – різниця електричних потенціалів між точкою в середині фази і безкінечно віддаленою точкою у вакуумі, потенціал якої приймається рівним нулю.
- звичайний хімічний потенціал і – того компоненту даної фази, zFФі – електрична енергія 1 моль заряджених частинок цього компонента в даній фазі, F – число Фарадея, тобто сумарний заряд 1 моль-екв. іонів, що несуть заряд z, Фі – різниця електричних потенціалів між точкою в середині фази і безкінечно віддаленою точкою у вакуумі, потенціал якої приймається рівним нулю.
Рівновага між зарядженими частинками і – того виду в двох фазах А і В наступає при рівновазі їх електрохімічних потенціалів  . Звідки випливає, що при рівновазі
. Звідки випливає, що при рівновазі
 , (XIV.2.2)
, (XIV.2.2)
де ψ – різниця потенціалів між точками в середині фаз А і В (y називають гальвані – потенціалом).
Стрибок потенціалу на межі метал – метал (міжфазний гальвані – потенціал) виникає внаслідок переважного переходу електронів з однієї металічної фази в іншу. Його прирівнюють величині контактної різниці потенціалів. Стрибок потенціалу між двома рідинами, що контактують, називається фазовим рідинним потенціалом, якщо розчинниками є дві рідини, що не змішуються. Якщо розчини відрізняються лише природою або концентрацією електроліту, то різниця потенціалів, що виникає, називається дифузійним потенціалом.
Різниця внутрішніх потенціалів між металом і розчином називається нернстівським потенціалом. Таким чином, різниця потенціалів електрохімічної системи, що розглядається, складається з стрибків потенціалу між двома металами, двох нернстівських потенціалів (на межі метал – розчин) і гальвані потенціалу розчин – розчин.
Треба відмітити, що контактна різниця потенціалів не завжди входить складовою частиною в ЕРС. Якщо обидва металевих електроди однакові, а обидва електроліти різні, то контактна різниця потенціалів рівна нулю. Нулю рівний і дифузійний потенціал у системах, в яких два металевих електроди знаходяться в контакті лише з одним розчином електроліту.
Якщо при протіканні процесів в електрохімічній системі відбуваються зміни лише на межі розділу метал – електроліт, то електрична енергія генерується лише за рахунок хімічних (точніше електрохімічних) перетворень і навпаки, при електролізі електрична енергія витрачається лише на вказані хімічні перетворення. Знайдемо кількісні зв’язки між електричними параметрами і величинами, що характеризують хімічний процес. Нехай в електрохімічній системі термодинамічно оборотньо при Т = const протікає процес:
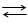 bB + dD rR + gG,
bB + dD rR + gG,
то при цьому виконується робота, що рівна зміні енергії Гіббса, яка береться зі знаком “мінус”:
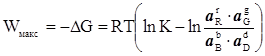 , (XIV.2.3)
, (XIV.2.3)
де К – константа рівноваги реакції, що розглядається, а – активності учасників реакції.
Співвідношення електричної роботи і роботи хімічної реакції можна записати так:
 , (XIV.2.4)
, (XIV.2.4)
де Е – ЕРС гальванічного елемента. Порівнюючи рівняння (XIV.2.3) і (XIV.2.4), отримуємо
 (XIV.2.5)
(XIV.2.5)
Для ідеальних розбавлених розчинів активності всіх учасників реакції можна замінити концентраціями, і тоді
 (XIV.2.6)
(XIV.2.6)
Позначивши через Еº ЕРС елемента, що відноситься до стандартних умов, тобто при
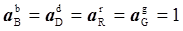
ми отримаємо
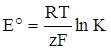 (XIV.2.7)
(XIV.2.7)
Величина Еº називається стандартною ЕРС елемента. Тоді рівняння можна подати у вигляді:
 , (XIV.2.8)
, (XIV.2.8)
яке було виведене Нернстом для розрахунків електрорушійних сил елементів.
Рівняння (XIV.2.5) і (XIV.2.6) дозволяють обчислювати ЕРС гальванічного елемента за даними про константу рівноваги та активностями чи концентраціями всіх учасників реакції. Ці ж рівняння дозволяють обчислювати константу рівноваги за значеннями виміряної величини ЕРС.
Скористаємось рівнянням Гіббса-Гельмгольца і порівняємо його з (XIV.2.4)
 (XIV.2.9)
(XIV.2.9)
Продиференціювавши (XIV.2.4) по Т, одержимо:  (z i F від температури не залежать). Підставивши значення величини ΔG з (XIV.2.4) і знайдене значення
(z i F від температури не залежать). Підставивши значення величини ΔG з (XIV.2.4) і знайдене значення  в (XIV.2.9), одержимо:
в (XIV.2.9), одержимо:
 , (XIV.2.10)
, (XIV.2.10)
або
 (XIV.2.11)
(XIV.2.11)
Рівняння (XIV.2.10) і (XIV.2.11) дозволяють легко і досить точно визначати величину ΔΗ (тепловий ефект хімічної реакції, що протікає в гальванічному елементі) за виміряною величиною ЕРС і похідною  . Останню визначають шляхом вимірювання Е при різних температурах. Температурний коефіцієнт ЕРС
. Останню визначають шляхом вимірювання Е при різних температурах. Температурний коефіцієнт ЕРС  може бути позитивним або негативним. У першому випадку (
може бути позитивним або негативним. У першому випадку ( >0) максимальна робота електричного струму перевищує зменшення ентальпії (-ΔΗ), і тому при роботі гальванічного елемента температура буде знижуватись. У другому випадку (
>0) максимальна робота електричного струму перевищує зменшення ентальпії (-ΔΗ), і тому при роботі гальванічного елемента температура буде знижуватись. У другому випадку ( <0), навпаки, температура електрохімічної системи буде підвищуватись. Значення температурного коефіцієнта ЕРС
<0), навпаки, температура електрохімічної системи буде підвищуватись. Значення температурного коефіцієнта ЕРС  використовується не лише для розрахунку теплового ефекту (ΔΗ) реакції, але і для зміни ентропії окисно – відновних реакцій:
використовується не лише для розрахунку теплового ефекту (ΔΗ) реакції, але і для зміни ентропії окисно – відновних реакцій:
 . (XIV.2.12)
. (XIV.2.12)
Поиск по сайту: