 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Електрохімічних систем
1.У відповідності з міжнародною угодою про знаки електрорушійних сил і електродних потенціалів будь-яку електрохімічну систему записують так: спочатку записується символ металу електрода, потім розчин, що містить відповідну сіль і знаходиться з ним в контакті, далі інший розчин, який знаходиться в контакті з другим електродом, і, на кінець, символ металу другого електрода. Символ металу електрода відділяють від символів розчину однією вертикальною рискою, а назви розчинів розділяють двома вертикальними рисками, якщо при цьому повністю усунутий дифузійний потенціал між ними, або однією пунктирною рискою, якщо дифузійний потенціал не усунутий. При позначенні електрохімічної системи (гальванічного елемента) зліва записують негативний електрод, справа – позитивний електрод. Наприклад, мідно – цинковий елемент схематично записують так:
(-) Zn│ZnSO4││CuSO4│Cu (+),
 якщо дифузійний потенціал усунутий,
якщо дифузійний потенціал усунутий,
(-) Zn│ZnSO4 CuSO4│Cu (+),
якщо дифузійний потенціал не усунутий.
2. Схематично концентраційний елемент записують так:
(-) Zn│ZnSO4││ZnSO4│Zn (+)
a 1 a 2
При а 1< а 2 лівий електрод зарядиться негативно, на ньому відбувається розчинення цинку.
3. Якщо електрод або розчин містить декілька різних речовин, то їх записують, відділяючи одну від одної комами. Так, водневий електрод, що з’єднаний з мідним електродом, який занурений у розчин сірчаної кислоти і міді (11) сульфату, записують так:
 (-) Н2, Pt│H2SO4 CuSO4,H2SO4│Cu (+)
(-) Н2, Pt│H2SO4 CuSO4,H2SO4│Cu (+)
4. При написанні електрохімічної системи замість сполук, що знаходяться в розчині, можна обмежитись лише іонами, які визначають величину потенціалу електрода (потенціал – визначаючі іони). Так, мідно – цинковий елемент можна записати так:
(-) Zn│Zn2+││Cu2+│Cu (+)
5. Величина ЕРС елемента позитивна. Тому при обчисленні ЕРС із величини потенціалу правого електрода віднімають величину потенціалу лівого електрода:
 (XIV.6.1)
(XIV.6.1)
6. Величина електродного потенціалу визначається як ЕРС електричної системи, в якій справа розташований даний електрод, а зліва стандартний водневий електрод, потенціал якого умовно прийнятий рівним нулю. Дифузійний потенціал при цьому вважається усунутим. Наприклад:
(-) Pt, (Н2)│H+││Cu2+│Cu (+)
мідний електрод заряджається позитивно, і, значить, в середині елемента струм (катіони) рухаються зліва направо. ЕРС такого елемента вважається позитивною і електродний потенціал міді позитивний.
При вимірюванні потенціалу цинку маємо
(+) Pt, (Н2)│H+││Zn2+│Zn (-)
Цинк заряджається негативно відносно водневого потенціалу, і, значить, струм в елементі йде справа наліво (в середині елемента). ЕРС такого елемента вважається негативною і електродний потенціал цинку негативний.
7. Окремі електроди (напівелементи) записують так, щоб речовина (іони), які знаходяться в розчині, були розміщені зліва:
Zn2+│Zn; Cl‾│Cl2, Pt; Cl‾│AgCl, Ag
8. Рівняння електродних реакцій записують так, щоб окиснені компоненти були зліва, наприклад:
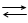

 Zn2+ + 2ē‘ Zn; ½ Cl2 + ē‘ Cl¯; Fe3+ + ē ‘ Fe2+
Zn2+ + 2ē‘ Zn; ½ Cl2 + ē‘ Cl¯; Fe3+ + ē ‘ Fe2+
Поиск по сайту: