 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XIV. 7. Вимірювання електрорушійних сил. Застосування методу вимірювання ЕРС для визначення різних фізико – хімічних величин
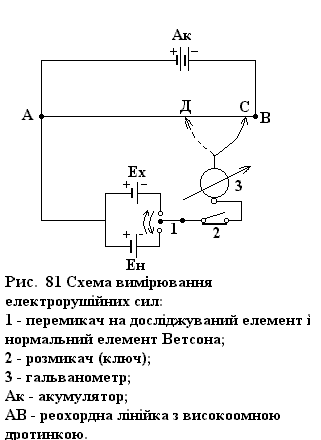 При вимірюванні ЕРС гальванічних елементів необхідно, щоб хімічна реакція в гальванічному елементі протікала оборотньо, що можливе лише при відсутності струму в колі. Якщо дозволити струму протікати через зовнішні кола, то в середині елемента буде проходити реакція, внаслідок якої концентрація іонів зміниться, а тому зміниться і ЕРС. Значить, ЕРС елемента повинна вимірюватись при сталому значенні складу розчину. З цією метою використовують так званий компенсаційний метод. Принцип компенсації полягає в тому, що ЕРС досліджуваного елемента зрівноважується протилежним за напрямком спаду напруги, яка створюється акумулятором на певному опорі (рис. 81). При цьому струм в колі досліджуваного елемента рівний нулю, відповідає вимогам оборотності.
При вимірюванні ЕРС гальванічних елементів необхідно, щоб хімічна реакція в гальванічному елементі протікала оборотньо, що можливе лише при відсутності струму в колі. Якщо дозволити струму протікати через зовнішні кола, то в середині елемента буде проходити реакція, внаслідок якої концентрація іонів зміниться, а тому зміниться і ЕРС. Значить, ЕРС елемента повинна вимірюватись при сталому значенні складу розчину. З цією метою використовують так званий компенсаційний метод. Принцип компенсації полягає в тому, що ЕРС досліджуваного елемента зрівноважується протилежним за напрямком спаду напруги, яка створюється акумулятором на певному опорі (рис. 81). При цьому струм в колі досліджуваного елемента рівний нулю, відповідає вимогам оборотності.
Встановлено, що спад потенціалу на будь-якому відрізку АС (рис. 81) відноситься до загального спаду потенціалу на дротині АВ, як довжина АС до довжини АВ:
 (XIV.7.1)
(XIV.7.1)
Бокове коло складається з елемента, величина ЕРС якого Ех підлягає вимірюванню, і гальванометра 3, який фіксує наявність електричного струму в боковому колі. Бокове коло закінчується контактом, який можна пересувати по реохордній лінійці.
При вимірюваннях пересувний контакт переміщують і знаходять точку компенсації (наприклад, точку С), при цьому гальванометр показуватиме відсутність струму в бічному колі. В момент компенсації ЕРС досліджуваного елемента Ех рівна спаду напруги акумулятора на відрізку дротини АС. З рівняння (XIV.7.1) матимемо
 . (XIV.7.2)
. (XIV.7.2)
Під час роботи акумулятора його напруга поступово зменшується, тому час від часу (краще перед кожним вимірюванням) точно вимірюють напругу акумулятора, та порівнюють її з еталонним джерелом електричної енергії, яка має сталу, таку, що не змінюється ЕРС. Таким еталонним джерелом електричної енергії є нормальний елемент Вестона. Останній підключають таким чином, щоб струм від елемента Вестона йшов назустріч струму акумулятора, тобто однойменними полюсами. Знаходять точку компенсації Д. Тоді аналогічно (XIV.7.2) матимемо
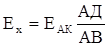 (XIV.7.3)
(XIV.7.3)
Проте обраховувати напругу акумулятора немає потреби, оскільки з (XIV.7.2) і (XIV.7.3) слідує:
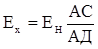 (XIV.7.4)
(XIV.7.4)
При вимірюваннях спочатку знаходять точку компенсації Д. Потім включають в коло досліджуваний елемент і знаходять точку компенсації С, після чого за (ХІV.7.4) обчислюють величину ЕРС.
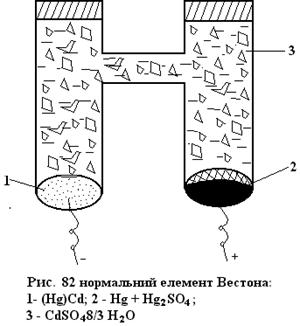
Елемент Вестона (рис. 82):
(-) (Hg)Cd│CdSO4·8/3 H2O, CdSO4(нас.)│Hg2SO4│Hg (+)
є гальванічним елементом без перенесення з точно відомою ЕРС (Ен = 1,0183В при 298К).
Негативний електрод складається з амальгами кадмію (розчин кадмію у ртуті), що знаходиться в насиченому розчині CdSO4, в якому містяться також кристалогідрати CdSO4·8/3 H2O. Позитивним електродом є ртуть, що покрита пастою Hg + Hg2SO4. На негативному і позитивному електродах протікають реакції:
 Cdº Cd2+ + 2ē‘ i
Cdº Cd2+ + 2ē‘ i 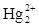 + 2ē‘ 2Hgº.
+ 2ē‘ 2Hgº.
Сумарний потенціалвизначаючий процес в елементі Вестона можна подати рівнянням:
 Hg2SO4 + Cd CdSO4 + 2Hg
Hg2SO4 + Cd CdSO4 + 2Hg
Оскільки ртуть знаходиться в контакті з своєю важкорозчинною сіллю Hg2SO4 (ДР = [  ]2[
]2[  ] = 6,3·10-7), а кадмій з кристалами CdSO4·8/3 H2O, то потенціали електродів під час роботи елемента мало змінюються. Це забезпечує добру стабільність ЕРС елемента. Вона зберігається довгий час, якщо елемент використовують лише для короткочасних вимірювань.
] = 6,3·10-7), а кадмій з кристалами CdSO4·8/3 H2O, то потенціали електродів під час роботи елемента мало змінюються. Це забезпечує добру стабільність ЕРС елемента. Вона зберігається довгий час, якщо елемент використовують лише для короткочасних вимірювань.
Вимірювання ЕРС гальванічних елементів застосовують для визначення різних фізико – хімічних величин. Для визначення таких величин важливо складати з оборотних електродів коло з перенесенням або без перенесення, визначити полярність електродів шляхом порівняння їх стандартних потенціалів, написати рівняння електродних реакцій і потенціал визначаючого процесу, а потім на їх основі – вираз для ЕРС кола. Далі ЕРС розраховують або вимірюють експериментально. Розглянемо окремі випадки застосування цього методу.
 1. Визначення значень стандартних електродних потенціалів. Склавши коло з досліджуваного електрода і відповідного електрода порівняння та вимірявши ЕРС цього кола розраховують невідомий стандартний електродний потенціал. Наприклад, для окиснювально-відновлювального електрода Fe3+, Fe2+│Pt, якому відповідає оборотна реакція Fe3+ + ē‘ Fe2+ беруть до пари хлор – срібний електрод і вимірюють ЕРС. В одержаному таким чином гальванічному елементі редокс – електрод, зазвичай, позитивний по відношенню до хлор – срібного, і
1. Визначення значень стандартних електродних потенціалів. Склавши коло з досліджуваного електрода і відповідного електрода порівняння та вимірявши ЕРС цього кола розраховують невідомий стандартний електродний потенціал. Наприклад, для окиснювально-відновлювального електрода Fe3+, Fe2+│Pt, якому відповідає оборотна реакція Fe3+ + ē‘ Fe2+ беруть до пари хлор – срібний електрод і вимірюють ЕРС. В одержаному таким чином гальванічному елементі редокс – електрод, зазвичай, позитивний по відношенню до хлор – срібного, і
 (ХІV.7.5)
(ХІV.7.5)
або
 (ХІV.7.6)
(ХІV.7.6)
Звідси
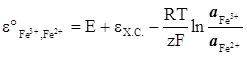 (ХІV.7.7)
(ХІV.7.7)
При використанні достатньо розбавлених розчинів (з концентрацією ≤ 0,0001 М) відношення активностей іонів три і двовалентного заліза можна заміняти відношенням концентрацій або при однаковій концентрації обох розчинів відношенням їх об’ємів.
2. Визначення термодинамічних характеристик хімічних реакцій. Розрахувавши або вимірявши ЕРС складеного елемента, можна визначити зміну енергії Гіббса за рівнянням (ХІV.2.4), тобто оцінити максимальну корисну роботу. Скориставшись значенням стандартних електродних потенціалів і обрахувавши за рівнянням  значення стандартної ЕРС кола, можна розрахувати нормальне хімічне споріднення:
значення стандартної ЕРС кола, можна розрахувати нормальне хімічне споріднення: 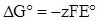 .
.
За виміряними значеннями ЕРС електрохімічних кіл при різних температурах розраховують температурний коефіцієнт ЕРС  . За рівняннями (ХІV.2.10) та (ХІV.2.12) знаходять ентальпію і ентропію для реакцій, що протікають в електрохімічному колі.
. За рівняннями (ХІV.2.10) та (ХІV.2.12) знаходять ентальпію і ентропію для реакцій, що протікають в електрохімічному колі.
3.Визначення константи рівноваги. Для визначення константи рівноваги реакції використовують рівняння (ХІV.3.9 – розділ хімічні рівноваги):
 , (ХІV.7.8)
, (ХІV.7.8)
де
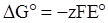 , (ХІV.7.9)
, (ХІV.7.9)
а Е˚ - стандартна ЕРС при середніх активностях всіх іонів у розчині, рівних одиниці. Скориставшись рівняннями (ХІV.7.8) і (ХІV.7.9), знаходимо, що
 (ХІV.7.10)
(ХІV.7.10)
4. Визначення коефіцієнта активності. Середні іонні активності і коефіцієнти активності визначають за допомогою вимірювання ЕРС хімічних елементів з одним електролітом, наприклад, для розчинів HCl
(-) (Pt), H2│HCl│AgCl│Ag (+)
Водневий електрод оборотній відносно іонів водню, хлор – срібний – відносно іонів хлору. ЕРС такого елемента можна розрахувати за такими співвідношеннями:
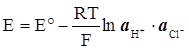 (ХІV.7.11)
(ХІV.7.11)
Враховуючи, що середня іонна активність для HСl рівна 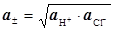 і
і 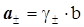 , отримаємо
, отримаємо
 (ХІV.7.12)
(ХІV.7.12)
Для розрахунку γ± за даними вимірювань Е необхідно знати ЕРС в стандартному стані Еº. Ця величина визначається одночасно з коефіцієнтом активності. Для цього рівняння (ХІV.7.12) перепишемо в такому вигляді:
 , (ХІV.7.13)
, (ХІV.7.13)
де  - функція концентрації розчину, що розраховується за експериментальними значеннями Е для розчинів різної концентрації. За одержаними даними будують графік у координатах (
- функція концентрації розчину, що розраховується за експериментальними значеннями Е для розчинів різної концентрації. За одержаними даними будують графік у координатах (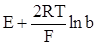 )-
)- 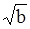 (рис. 83)
(рис. 83)
При b → 0 γ± → 1, таким чином, при екстраполяції прямої на вісь ординат відсікається відрізок, що відповідає
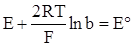 (ХІV.7.14)
(ХІV.7.14)
При 298 К з урахуванням сталих величин з (ХІV.7.12) отримаємо
 (ХІV.7.15)
(ХІV.7.15)
 5. Визначення рН розчинів. Визначення рН розчинів проводять практично у всіх хімічних лабораторіях і на виробництві при автоматичному контролі і регулюванні кислотності розчинів. Для цього вимірюють ЕРС елемента, що складається з індикаторного електрода і електрода порівняння, які підбирають з урахуванням їх переваг і недоліків, а також у відповідності з природою досліджуваних розчинів.
5. Визначення рН розчинів. Визначення рН розчинів проводять практично у всіх хімічних лабораторіях і на виробництві при автоматичному контролі і регулюванні кислотності розчинів. Для цього вимірюють ЕРС елемента, що складається з індикаторного електрода і електрода порівняння, які підбирають з урахуванням їх переваг і недоліків, а також у відповідності з природою досліджуваних розчинів.
Для вимірювання рН з водневим електродом складають коло, використовуючи хлор – срібний електрод в ролі електрода порівняння. З рівняння для ЕРС ланцюга Е = εCl¯/AgCl,Ag –  знаходимо формулу для розрахунку рН
знаходимо формулу для розрахунку рН
 , (ХІV.7.16)
, (ХІV.7.16)
де εCl¯/AgCl,Ag = 0,222В при 298 К, Е – виміряна ЕРС ланцюга.
Можуть використовуватись і інші подібні системи для вимірювання рН. Для вимірювання рН, як вже зазначалось вище, широко використовують скляні електроди.
6.Потенціометричне титрування. Потенціометричним титруванням називають метод визначення концентрації або кількості речовини за потенціометричними кривими титрування (рис. 84), які одержують багатократним вимірюванням ЕРС ланцюга після кожного додавання порції титранта до титрованого розчину, що знаходиться в гальванічному елементі, який складається з індикаторного електрода і електрода порівняння.
Титрант добавляють до розчину, що титрується малими порціями (по 0,1 – 0,2 мл), доки реакція з речовиною що визначається, не закінчиться, а для одержання кривої титрування розчин перетитровують на 30 – 50%. Мета титрування полягає в додаванні титранта в кількості, що хімічно еквівалентна кількості реагуючої з ним речовини. Ця мета досягається в точці еквівалентності (т.е.). Проте операцією титрування визначається, по суті, не т.е., а кінечна точка титрування (к.т.т.). При цьому припускають, що різниця об’ємів в т.е. і к.т.т. мала, а похибка аналізу, що виникає за рахунок цієї різниці, незначна. Потенціометричне визначення к.т.т. можливе, якщо в області т.е. спостерігається різка зміна потенціалу, а це досягається в тому випадку, коли в області т.е. спостерігається різка зміна концентрації іонів, що відтитровуються, як це показано на рис. 84. Зв’язок між зміною концентрації іонів, що відтитровуються, і потенціалу індикаторного електроду подається рівнянням (ХІV.7.16). 
Потенціал електрода порівняння в процесі титрування не змінюється. Потенціометричне титрування може бути засноване на реакціях нейтралізації, комплексоутворення, осадження. В залежності від реакцій, що лежать в основі титрування, підбирають титранти, способи визначення їх концентрації й еквівалентної маси. Типом реакції, що протікає, визначається і вибір індикаторного електрода.
В деяких випадках (при зменшенні стрибка потенціалу при титруванні слабких кислот і слабких лугів та утруднення виявлення к.т.т.) для визначення точки еквівалентності будують графік титрування не в координатах Е¸V а в координатах DЕ/DV¸V (рис. 84, б). В цих координатах при потенціометричному титруванні точка еквівалентності визначається як точка максимуму на кривій титрування.
За останні роки потенціометричне титрування як фізико – хімічний метод аналізу стали широко застосовувати для аналізу неводних розчинів, особливо у фармації.
Поиск по сайту: