 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XV. 1. Загальна характеристика електрохімічних процесів
XV. Нерівноважні електродні процеси
При електролізі й експлуатації електрохімічних джерел струму через електрохімічні системи протікає електричний струм. Якщо в електрохімічному колі протікає електричний струм, то воно знаходиться в нерівноважному стані. Назвемо електродним процесом суму всіх змін, що відбуваються протягом часу на поверхні електроду при потенціалі, який відрізняється від рівноважного.
Всі електродні процеси можна розділити на дві групи: процеси електровідновлення і процеси електроокиснення. Якщо електрони переходять від електрода (катода) до частинок, що містяться в розчині чи розплаві (Ox + z ē → Red), то такі процеси називаються процесами електровідновлення. Якщо ж електрони переходять від частинок на електрод, якай називається анодом, то протікає процес електроокиснення (Red - z ē → Ox).
Електричний струм, що проходить через межу електрод – іонна система, пов’язаний з протіканням електродного процесу (фарадеївський струм) і зарядкою подвійного шару (струм зарядки). Якщо стан поверхні електроду не змінюється в часі, то величина струму І вимірюється лише швидкістю самого електродного процесу. При таких умовах швидкість електродної реакції може бути безпосередньо виміряна за допомогою приладів, що фіксують струм у колі.
Величина струму І буде визначатися не лише швидкістю електрохімічної реакції, але і величиною поверхні електрода S. Тому для характеристики швидкості електродного процесу використовують густину струму j = I/S.
Будь-який електродний процес складається з ряду стадій, причому деякі з них зустрічаються в кожному електродному процесі. До таких стадій відносяться підведення реагуючої речовини до поверхні електрода з об’єму розчину (розплаву) або з об’єму електрода, перенесення заряджених частинок (електронів або іонів) через межу розділу фаз і відведення продуктів реакції в об’єм розчину (розплаву) або в глибину електрода. Першу і третю стадії називають стадіями масоперенесення. Друга стадія називається стадією розряду або іонізації. Крім цих стадій при протіканні електродних реакцій зустрічаються також і інші. Так, в деяких випадках електродні процеси ускладнюються хімічними реакціями в об’ємі розчину або на поверхні електроду, в яких можуть брати участь вихідні речовини або продукт електрохімічної реакції. При електоосадженні металів або виділенні газоподібних продуктів зустрічається стадія утворення нової фази (кристалічних зародків або бульбашок газу). Протягом електрохімічного процесу може відбуватися переміщення частинок по поверхні електрода (поверхнева дифузія) від центрів, на яких відбувається розрядження, до деяких інших, де продукту реакції знаходитись найбільш вигідно. Якщо поверхня електрода несе заряд, протилежний за знаком заряду реагуючої частинки, то необхідно враховувати можливість повільного входження реагуючої частинки у подвійний електричний шар.
При протіканні постійного електричного струму через електрохімічні системи на електродах, як вище відмічалось, виникають електрохімічні реакції, причому співвідношення між кількістю електрики і масами речовин, що прореагували, виражається законами Фарадея.
1 – й закон. Маса m речовини, що піддається хімічному перетворенню під дією електричного струму, пропорційна кількості електрики q, що протікає через дану систему:
 (ХV.1.1)
(ХV.1.1)
де І – сила струму; t – час; Ке – деякий коефіцієнт пропорційності; q – кількість електрики, що дорівнює добутку сили струму І на час t. Якщо q = It = 1, то m = Kе, тобто коефіцієнт Ке – маса речовини, що прореагувала внаслідок проходження одиниці кількості електрики. Коефіцієнт пропорційності Ке називається електрохімічним еквівалентом.
2 – й закон. При проходженні через різні електроліти однієї і тієї ж кількості електрики маси різних речовин, що беруть участь в електродних реакціях, пропорційні їх молярним масам еквівалентів (Мекв):

З другого закону випливає, що для електрохімічного перетворення 1 моль – екв. будь-якої речовини необхідна однакова кількість електрики F, що називається сталою Фарадея. Вона рівна 96485 Кл/моль – екв. або 26,8 А·год/моль – екв.
Рівняння, що об’єднує обидва закони Фарадея:
 , (ХV.1.2)
, (ХV.1.2)
де z – число електронів, що бере участь в електрохімічній реакції.
Закони Фарадея є найзагальнішими і найточнішими кількісними законами електрохімії. Проте здебільшого електрохімічної зміни зазнає менша кількість даної речовини, ніж слід було б сподіватися, виходячи із законів Фарадея. Ці відхилення уявні і виникають за рахунок одночасного протікання побічних електрохімічних процесів, хімічних реакцій, в які вступає продукт, і його втрат.
Щоб врахувати вплив побічних реакцій та інших процесів, введено поняття виходу за струмом Вст. Виходом за струмом називається відношення маси, практично виділеної при електролізі речовини mпр, до тієї маси mт, яка повинна була б виділитися за законом Фарадея:
 (ХV.1.3)
(ХV.1.3)
Якщо в рівнянні (ХV.1.2) масу речовини, що бере участь в реакції, виразити в молях, то швидкість електрохімічної реакції буде
 (ХV.1.4)
(ХV.1.4)
При S = 1
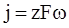 (ХV.1.5)
(ХV.1.5)
jk
 Електродна рівновага Ox + z ē‘ Red є динамічною, при якій
Електродна рівновага Ox + z ē‘ Red є динамічною, при якій
ja
швидкості реакцій електровідновлення (jk) і електроокиснення (ja) однакові, звідки:
jk=ja=j0 (ХV.1.6)
де j0 – густина струму обміну. Ця величина є мірою швидкості обмінного процесу в умовах рівноваги і залежить від природи реакції і концентрації речовин, що беруть у ній участь.
Поиск по сайту: