 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XV.4. Електрохімічна перенапруга
|
Читайте также: |
Із вчення про хімічну кінетику відомо, що швидкість найбільш повільної стадії має вирішальний вплив на швидкість процесу в цілому. Тому, якщо швидкість електрохімічної реакції мала в порівнянні з швидкістю дифузії, то загальна швидкість процесу визначається головним чином швидкістю реакції. Тобто, електрохімічна перенапруга виникає тоді, коли найбільш повільною стадією електродного процесу є власне електрохімічна реакція.
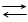 Розглянемо основи теорії електрохімічної перенапруги стосовно катодної реакції Ox + z ē‘ Red. Відомо, що швидкість будь-якої хімічної гетерогенної мономолекулярної реакції w на межі розділу тверда фаза – рідина, віднесена до одиниці площі, рівна:
Розглянемо основи теорії електрохімічної перенапруги стосовно катодної реакції Ox + z ē‘ Red. Відомо, що швидкість будь-якої хімічної гетерогенної мономолекулярної реакції w на межі розділу тверда фаза – рідина, віднесена до одиниці площі, рівна:
 , (ХV.4.1)
, (ХV.4.1)
де с – концентрація реагуючої речовини в рідкій фазі, що безпосередньо прилягає до поверхні твердого тіла, k – константа швидкості хімічної реакції, Еакт – енергія активації.
Швидкість електродної реакції зручно виражати через густину струму. Тоді рівняння (ХV.4.1) можна записати у вигляді:
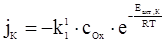 (ХV.4.2)
(ХV.4.2)
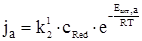 , (ХV.4.3)
, (ХV.4.3)
де jК і jА – катодна і анодна густини струму, Еакт,к і Еакт,а – енергії активації катодної і анодної реакцій.(Знак “мінус” перед правою частиною рівняння (ХV.4.2) необхідний, щоб одержати негативне значення катодного струму).
В момент рівноваги швидкості катодного і анодного процесів однакові і тоді:
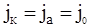 (ХV.4.5)
(ХV.4.5)
де j0 – густина струму обміну. Якщо з допомогою зовнішнього джерела електричної енергії змінити величину потенціалу на η, зробивши його більш негативним, то швидкість катодного процесу буде перевищувати швидкість анодного процесу. Прискоренню прямої реакції сприяє деяка частина α загальної енергії електричного поля zFη, а сповільненню зворотної – друга частина енергії поля (1 – α). Величина α називається коефіцієнтом перенесення і його значення змінюється від 0 до 1.
Для електрохімічних реакцій характерна залежність енергії активації від потенціалу:

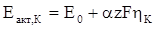 ,
, 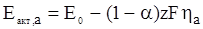 (ХV.4.6)
(ХV.4.6)
де Е0 – частина енергії активації процесу, що не залежить від потенціалу; αzFη і (1 – α)zFη – частина енергії активації, що залежить від потенціалу.
Підставляючи рівняння (ХV.4.6) в рівняння (ХV.4.2) і (ХV.4.3), отримаємо:
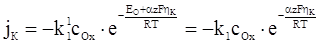 , (ХV.4.7)
, (ХV.4.7)
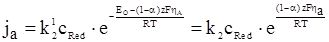 , (ХV.4.8)
, (ХV.4.8)
де 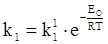 ,
, 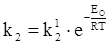 .
.
З рівнянь (ХV.4.7) і (ХV.4.8) випливає, що швидкість катодної реакції jК зростає при зміщенні потенціалу в негативну сторону значень, а анодний ja – в позитивну сторону.
В рівняннях (ХV.4.7) і (ХV.4.8) k1 і k2 відповідають катодній і анодній густині струму при рівновазі. А при рівновазі катодний і анодний струми рівні і визначають струм обміну. Скориставшись цим, рівняння (ХV.4.7) і (ХV.4.8) можна записати так:
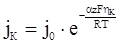 , (ХV.4.9)
, (ХV.4.9)
 (ХV.4.10)
(ХV.4.10)
З рівняння (ХV.4.9) і (ХV.4.10) випливає, що швидкість електродної реакції при всіх інших рівних умовах (рівній перенапрузі, рівних коефіцієнтів перенесення, рівній температурі) тим більша, чим більший струм обміну j0. Сумарна швидкість катодної реакції рівна
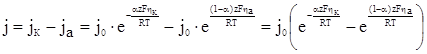 (ХV.4.11)
(ХV.4.11)
У момент рівноваги jК = ja і j = 0.
В області малих значень густини струму і перенапруги електрохімічна система незначно відхилена від рівноважного стану і zFη < RT. Тому з рівняння (XV.4.11) після перетворення і спрощення отримуємо
η = – 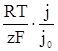 (XV.4.12)
(XV.4.12)
З цього рівняння виходить, що перенапруга при даній густині струму тим менша, чим більша густина струму обміну.
Якщо через електрохімічну систему проходить значний струм і вона суттєво відхиляється від рівноважного стану, то швидкість прямої реакції набагато більша швидкості зворотної і останньою можна знехтувати. Рівняння (XV.4.11) набуває вигляду:
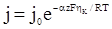 , (XV.4.13)
, (XV.4.13)
звідки отримуємо залежність електрохімічної перенапруги від густини струму:
η = 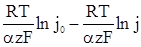 (XV.4.14)
(XV.4.14)
Густина струму обміну j0 і коефіцієнт переносу є кінетичними параметрами реакції, що супроводжується електрохімічною перенапругою. Струм обміну визначається природою електрохімічної реакції, складом розчину і температурою. Коефіцієнт переносу α для ряду електрохімічних реакцій близький до 0,5. Якщо в рівнянні (XV.4.14) позначити
 (XV.4.15)
(XV.4.15)
і
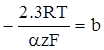 , (XV.4.16)
, (XV.4.16)
то його можна подати в такому вигляді:
η = a + b lg j. (XV.4.17)
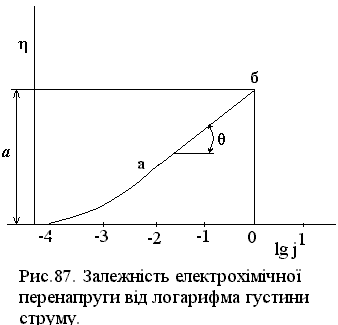
Аналогічне рівняння було одержане Тафелем (1905) при експериментальному вивченні перенапруги при виділенні водню. Тому рівняння (XV.4.17) називають рівнянням Тафеля, а константи a і b тафелівськими сталими.
Графічну залежність електрохімічної перенапруги від густини струму зручно виражати поляризаційними кривими в напівлогарифмічних координатах (рис. 87). В області значних перенапруг у відповідності з рівнянням (XV.4.17) на кривій є прямолінійна ділянка аб, яка дає можливість визначити тафелівські сталі. На одержаній експериментально поляризаційній кривій стала а відповідає перенапрузі при j = 1 (ln j = 0), а b – тангенсу кута θ нахилу прямолінійної ділянки аб. За одержаними значеннями а і b можна розрахувати кінетичні параметри електрохімічної реакції–струм обміну j0 і коефіцієнт переносу α.
У кінетиці перебігу стадії переносу заряду, сповільненість якої є безпосередньою причиною виникнення електрохімічної перенапруги, особливу роль повинна відігравати будова подвійного електричного шару на межі поділу двох фаз.
 Справді, якщо інші стадії електродного процесу – транспортування частинок і гомогенне хімічне перетворення відбувається хоч і поблизу межі поділу електрод–електроліт, але далеко за межами подвійного шару, то власне електрохімічний акт розігрується всередині цього шару. Тому розподіл потенціалу в подвійному шарі і положення в ньому частинок, які реагують, повинні істотно впливати і на величину електрохімічного акту, і на величину електрохімічної перенапруги. Тому при розрахунку перенапруги необхідно враховувати не величину електродного потенціалу ε і концентрацію реагуючих речовин в об’ємі електроліту, а спад потенціалу і концентрацію реагуючих іонів у щільній частині подвійного електричного шару. Тоді в рівняння (XV.4.14) вводиться додатковий член, що містить Ψ1 потенціал:
Справді, якщо інші стадії електродного процесу – транспортування частинок і гомогенне хімічне перетворення відбувається хоч і поблизу межі поділу електрод–електроліт, але далеко за межами подвійного шару, то власне електрохімічний акт розігрується всередині цього шару. Тому розподіл потенціалу в подвійному шарі і положення в ньому частинок, які реагують, повинні істотно впливати і на величину електрохімічного акту, і на величину електрохімічної перенапруги. Тому при розрахунку перенапруги необхідно враховувати не величину електродного потенціалу ε і концентрацію реагуючих речовин в об’ємі електроліту, а спад потенціалу і концентрацію реагуючих іонів у щільній частині подвійного електричного шару. Тоді в рівняння (XV.4.14) вводиться додатковий член, що містить Ψ1 потенціал:
η =  (XV.4.18)
(XV.4.18)
Оскільки Ψ1–потенціал змінюється в залежності від загальної концентрації розчину електроліту або від присутності в ньому поверхнево активних речовин, рівняння (XV.4.18) відбиває вплив розчину на перенапругу.
Існують, як уже відзначалося вище, й інші види перенапруги: реакційна, фазова.
Реакційна перенапруга викликана сповільненням стадії хімічної реакції, що передує електрохімічній стадії або послідуюча їй. Наприклад, якщо катодне виділення срібла здійснюється не з розчину її простої солі, а з розчину його комплексної сполуки, наприклад ціаніду, то електродний процес буде складнішим. Можна передбачити, що виділенню металевого срібла передують хімічні реакції:
Ag(CN)2‾ = AgCN + CN‾
або
Ag(CN)2‾ = Ag+ + 2CN‾,
а потім
AgCN + ē‘ = Ag + CN‾
Ag+ + ē‘ = Ag.
Прикладом послідуючої хімічної реакції може слугувати електрохімічне виділення водню. Внаслідок розряду іонів H3O+ утворюються атоми водню, які потім беруть участь в реакції молізації 2Н→Н2.
Розрахунок перенапруги ηр залежить від того, в якій із стадій, попередній чи послідуючій, спостерігається найбільше гальмування. Якщо найбільш повільною є остання, то залежність перенапруги від густити струму j виразиться рівнянням:
ηр = – 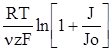 , (XV.4.19)
, (XV.4.19)
де ν–порядок реакції.
Фазова перенапруга обумовлена гальмуванням на стадії фазових перетворень в умовах електродної реакції (утворення газів, твердих і рідких металів, оксидів тощо). Розглянемо, як приклад, кристалізацію. Атоми металів, що утворюються при розряді катіонів, спочатку знаходяться в адсорбованому стані на поверхні катода (вони називаються ад–атомами). Перенапруга викликається гальмуванням на стадії входження ад–атомів у кристалічну решітку. Згідно з Фольмером, процес електрокристалізації іде в дві стадії: виникнення центрів кристалізації (кристалічних зародків) і їх ріст. Центр кристалізації – ущільнення атомів, навколо якого розпочинається ріст кристалів. Розрізняють двомірні (товщина в один атом) і три мірні (товщиною більше одного атома) зародки.
Ад–атоми в процесі електрокристалізації беруть участь або в утворенні кристалічних зародків, або в їх рості. При цьому атоми повинні прийняти орієнтовне положення в кристалічній решітці. Гальмування на цій стадії електродного процесу супроводжується виникненням перенапруги. Загальна кристалізаційна перенапруга складається з перенапруги, що відповідає утворенню двомірних (η1) і тримірних(η2) зародків і приєднання ад–атомів до кристалічної решітки (η3):
ηор = η1 + η2 + η3. (XV.4.20)
Перевага тієї чи іншої складової визначається природою металу, що осаджується, умовами електролізу і часом формування осадка.
Поиск по сайту: