 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XV.5. Теорія водневої перенапруги
Реакція катодного виділення водню–одна з найбільш розповсюджених реакцій. Вона є основною реакцією при електролітичному виділенні водню, допоміжною при виробництві багатьох речовин, що утворюються на аноді, в тому числі при виробництві хлору, побічною реакцією значної кількості катодних процесів, зокрема в гідроелектрометалургії. Вона відіграє значну роль при корозії металів. Характерна особливість цієї реакції–можливість протікання в будь-якому водному розчині, без додавання спеціальних реагентів.
Таким чином, у зв’язку з великим практичним значенням реакції виділення водню її, вивчили найбільш детально.
Електролітичне виділення водню з кислих і лужних розчинів відбувається різними шляхами. Джерелом водню в кислих розчинах є гідроксонієві іони, розрядження яких на катоді приводить до утворення газоподібного водню:
2Н3О+ + 2ē‘= Н2 + 2Н2О
У лужних розчинах, гадають, що електрони приєднуються безпосередньо до молекул води з наступним розпадом на водень і гідроксильні іони:
2Н2О + 2ē = Н2 + 2ОН¯
Виділення водню супроводжується значною перенапругою, яка залежить від природи електрода, складу розчину і умов електролізу. В першу чергу слід відмітити вплив на перенапругу густини струму, що виражається емпіричною формулою Тафеля:
η = а + b lg j, (XV.5.1)
яка співпадає з теоретичним рівнянням (XV.4.17).
Формула Тафеля відбиває також вплив матеріалу електрода на перенапругу, оскільки сталі а і b неоднакові для різних матеріалів.
Значення сталих а і b у формулі Тафеля для електролітичного виділення водню з кислих розчинів на деяких металах при 298 К наведені нижче:
Метал Pt Pd Au Co Ni Cu Ag Sn Zn Hg Pb
a 0,1 0,24 0,40 0,62 0,63 0,87 0,95 1,20 1,24 1,41 1,54
b 0,03 0,03 0,12 0,14 0,11 0,12 0,10 0,13 0,12 0,11 0,11
Величина а, як вже відмічалось вище, відповідає перенапрузі на даному металі при j = 1А/см2. Для Pt, Pd величина а, відповідно, і перенапруга відносно невеликі; в той же час можна виділити групу металів з високим значенням а і перенапругою (Sn, Zn, Hg, Pb). Коефіцієнт b при переході від одного металу до іншого змінюється мало і в середньому складає 0,11–0,12. Стан поверхні металу суттєво впливає на величину перенапруги водню. Перенапруга цього процесу на жорсткуватій поверхні нижча, ніж на полірованій. З підвищенням температури перенапруга падає, при цьому температурний коефіцієнт залежить від природи металу: для металів з низькою перенапругою він складає 1–2 мВ/К, для металів з високою перенапругою –2–4 мВ/К.
Розряд іонів гідроксонію, що приводить до виділення молекулярного водню, здавалось би, є найпростішою електродною реакцією, але і вона виявляється досить складною, оскільки включає ряд послідовних стадій:
1) транспорт Н3О+ чи Н2О з об’єму електроліту до електрода;
2) приєднання електрона (розряд), внаслідок якого утворюються атоми водню, що адсорбуються на поверхні електрода
Н3О+ + ē → Надс + Н2О
або
Н2О + ē → Надс + ОН‾
3) видалення адсорбованих атомів водню з поверхні електрода. Для здійснення цієї стадії можливі різні шляхи:
а) рекомбінація атомів у молекулу з одночасною десорбцією, причому метал електрода відіграє роль каталізатора:
2Надс → Н2
б) електрохімічна десорбція – видалення адсорбованих атомів з поверхні електрода відбувається внаслідок протікання на цих атомах електрохімічної реакції:
Н3О+ + Надс + ē → Н2 + Н2О
або
Н2О + Надс + ē → Н2 + ОН‾
в) емісія–випаровування з поверхні електрода адсорбованих атомів у вигляді вільних з подальшою їх рекомбінацією в молекулу Над→Н і 2Н→Н2. Всі три механізми видалення адсорбованого водню здійснюються одночасно, проте в конкретних умовах один з них відіграє вирішальну роль;
4) перехід у газову фазу молекул водню, що утворились на межі електрод–електроліт.
Із чотирьох стадій електродного процесу одна є лімітуючою. Яка саме? Різні теорії відповідають на запитання по-різному.
В даний час найбільше визнання отримала теорія сповільненого розряду, згідно з якою лімітуючою стадією є стадія приєднання електрона до реагуючої частинки. Основні положення і кінетичні рівняння цієї теорії співпадають з теорією електрохімічної перенапруги, що розглянута вище. В застосуванні до електродної реакції Н3О+ + ē → Н + Н2О рівняння для перенапруги має вигляд:
η = 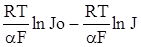 (XV.5.2)
(XV.5.2)
Для даної реакції величина густини струму обміну залежить від природи металу, на якому вона протікає. Значить, перший член рівняння (XV.5.2) у відповідності з емпіричною формулою Тафеля визначається природою катода. Для реакції виділення водню коефіцієнт перенесення α = 0,5. При цьому розрахований коефіцієнт b при 298 К рівний 0,118. Достатньо задовільне співвідношення цієї величини з дослідними значеннями для багатьох металів свідчить про справедливість теорії сповільненого розряду. Іноді доцільно розглядати в ролі лімітуючої інші стадії процесу виділення водню. В даний час передбачається, що для Hg, Tl, Pb, Zn, Sn, Cd і інших перенапруга визначається стадією розряду, що протікає повільно. Видалення адсорбованого водню при цьому відбувається за рахунок швидкої стадії електрохімічної десорбції. На металах групи платини і, можливо, заліза найбільш повільною стадією є рекомбінація атомів водню в молекулу. В цьому випадку перенапруга відповідає реакційній перенапрузі і описується рівнянням (XV.4.19).
Виникнення перенапруги є загальним явищем для електрохімічних процесів, оскільки значні перенапруги виникають при електролітичному виділенні не лише водню, але й інших газів.
Як теоретично, так і практично велику зацікавленість має процес електрохімічного виділення кисню. Цей процес внаслідок високої хімічної активності кисню ускладнюється утворенням на металах різних оксидів навіть на платині, тому виділення газоподібного кисню відбувається на окисненій поверхні. Те, що до цих пір немає достатньо обґрунтованої теорії кисневої перенапруги, пояснюється, мабуть, головним чином складністю виділення кисню.
Поиск по сайту: