 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XII.4. Теорії гетерогенного каталізу
В даний час не існує єдиної теорії гетерогенних каталітичних реакцій, на основі якої можна було б безпомилково вибрати для кожної реакції найбільш придатний каталізатор. Окремі теорії пояснюють лише окремі випадки складних каталітичних явищ.
Розглянемо деякі теорії гетерогенного каталізу.
Мультиплетна теорія, що запропонована А.А.Баландіним, виходить із принципу структурної (або геометричної) відповідності між розташуванням атомів на активних ділянках поверхні каталізатора і будовою молекул речовини, що реагує. Таким чином теорія розглядає не просто взаємодію молекул в цілому з поверхнею каталізатора, а взаємодію окремих атомів або атомних груп у молекулі речовини, що реагує, (так званих індексних груп) з певними геометрично правильними угрупуваннями атомів або іонів поверхневого шару каталізатора. Згідно з цією теорією активними центрами на поверхні каталізатора є мультиплети. Мультиплети – це невеликі, що складаються з декількох атомів або іонів (2,3,4,6), ділянки кристалічної гратки каталізатора, що мають правильну конфігурацію, яка залежить від будови всієї кристалічної гратки каталізатора. Адсорбована молекула “сідає” на такий мультиплет так, що різні її індексні групи зв’язуються з різними атомами мультиплету. При цьому зв’язки між атомами адсорбованих молекул схильні розриватися, якщо атоми індексної групи адсорбовані на різних атомах мультиплету. Наприклад, дегідрування етилового спирту, згідно з теорією мультиплетів, відбувається на дуплеті, причому до одного атома дуплету (К) притягуються водневі атоми груп СН2 і ОН, а атом кисню і вуглецевий атом – до другого (К1). Внаслідок чого відбувається розрив зв’язків С – Н і О – Н з утворенням нових: Н – Н і С = О в молекулах оцтового альдегіду і водню (атоми дуплету на поверхні каталізатора зображені точками):
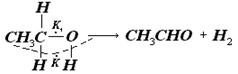
Якщо віддалі між атомами каталізатора в дуплеті будуть іншими, то можливий інший процес: водневий атом групи СН3 і кисневий атом притягнуться до одного атома дуплету, а обидва вуглецевих атома до другого. Внаслідок цього продуктами реакції будуть етилен і вода:
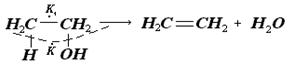
Каталітичний ефект суттєво залежить від співвідношення віддалей між атомами активного центру і атомами в індексній групі молекули, що реагує. Досвід показує, що в реакціях дегідрування циклопарафінів каталізаторами придатні лише ті метали, на поверхні яких атоми розташовані у вигляді гратки з рівносторонніх трикутників, при цьому віддалі між атомами повинні знаходитись у межах від 0,247 (Ni) до 0,28 нм (Pt). Окрім нікелю і платини каталітично активні Pb (0,247 нм), Rh (0,268 нм), гратки яких гранецентровані. Але такі метали, як Th (0,36 нм), Au і Ag (0,288 нм), гратки яких також гранецентровані, каталітично не активні. Так теорія пояснює специфічність каталізаторів. Дія промоторів обумовлена тим, що їх атоми добудовують мультиплет або змінюють його будову. Дія отрут пояснюється їх міцною адсорбцією на мультиплетах, блокуванням одного або декількох атомів і порушенням, таким чином, структурної відповідності.
Іншим положенням мультиплетної теорії є принцип енергетичної відповідності, згідно з яким енергія зв’язку індексних атомів з атомами мультиплету повинна відповідати найменшій енергії активації реакції. Індексні атоми реагенту і атоми мультиплету, що належать каталізатору, утворюють мультиплетний комплекс. Збільшення спорідненості вихідних речовин до каталізатора полегшує утворення мультиплетного комплексу, але ускладнює його руйнування. Найбільша активність каталізатора досягається при певній енергії цього комплексу, коли швидкість його утворення і розпаду будуть близькі один до одного.
Теорія активних ансамблів. Згідно з цією теорією каталітично активним центром є сукупність (ансамбль) вільних атомів каталізатора, що знаходяться на окремій ділянці блоку поверхні твердого тіла. Такою поверхнею (підкладкою) можуть бути силікагель, активоване вугілля, алюмогель та ін., а каталізаторами – такі метали, як срібло, платина, мідь, талій, нікель. Атоми каталізатора не входять у кристалічну гратку і можуть вільно мігрувати в межах кожного блоку. Розділення поверхні на окремі блоки відбувається внаслідок утворення мікроскопічних тріщин, наявності домішок і різного роду неоднорідностей поверхні реальних тіл.
Досліди показали, що каталітична активність адсорбційних каталізаторів зі збільшенням кількості атомів каталізатора, що знаходяться на поверхні носія, зазвичай, зростає лише до деякої межі, а потім зменшується. Утворення максимуму на кривій активності з ростом ступеня заповнення поверхні атома каталізатора (відношення площі зайнятої поверхні до всієї поверхні каталізатора) пояснюється зміною числа ансамблів, що складаються для кожної реакції зі строго певної кількості атомів.
Теорія активних ансамблів дозволяє використати дослідні дані для розрахунку кількісного складу і активності каталітично активних центрів. Було встановлено, що для окиснювальних процесів активним є одноатомний ансамбль, для реакцій гідрування – двохатомний і тд. Зміна структури поверхні і розміру блоків, що відбувається при введенні домішок або внаслідок термообробки і рекристалізації, впливає на кількість атомів в ансамблях. Цим пояснюється промотування, дія отрут і вплив способу приготування каталізатора на його активність.
Теорія активних ансамблів не враховує хімічну природу каталізатора і речовин, що вступають у реакцію. Всі випадки каталізу з ансамблем, що складається з однакової кількості атомів, виявляються рівноцінними незалежно від хімічної природи речовин і умов протікання реакції.
Електронні теорії каталізу. Є дані, що вказують на важливу роль вільних і слабко зв’язаних електронів каталізатора в каталітичній реакції. До таких можна віднести каталітичні властивості перехідних металів, що володіють недобудованою d-оболонкою; каталітичну властивість напівпровідників, електрони яких можуть здійснювати переходи між рівнями заповненої і вільної зон і рівнями домішок; паралелізм, що спостерігається між каталітичними і такими властивостями речовин, як електропровідність, робота виходу електрона тощо. Наприклад, паралелізм між величиною роботи виходу електрона і каталітичною активністю металу виявляється в реакції розкладу пероксиду водню на міді або нікелі. Одна з стадій реакції полягає в дисоціації молекули пероксиду водню:
Н2О2 + ē → ОН• + ОН‾
Електрон, що необхідний для здійснення цієї стадії, надається металом і, мабуть, тим легше, чим менша робота виходу електрона для даного каталізатора. Досвід показує, що мідь – більш активний каталізатор розкладу пероксиду водню, ніж нікель. Це відповідає тому, що робота виходу електрона у міді (4,1 еВ) менша, ніж у нікелю (4,9 еВ).
Створенню електронної теорії каталізу на напівпровідниках присвячені роботи Ф.Ф.Волькенштейна. В цій теорії розглядається напівпровідниковий каталізатор, що представляє собою ідеальний кристал, утворений іонами з оболонкою інертного газу. При температурі вищій абсолютного нуля в зоні провідності такого кристалу є електрони, що забезпечують вільні валентності на його поверхні. Ці електрони беруть участь в утворенні зв’язків частинок, що адсорбуються, з поверхнею кристалу. Можливі три типи зв’язків. 1. Слабкий гомеополярний зв’язок, що забезпечується валентним електроном одного з атомів, що адсорбується, який втягується в зону провідності кристалу. 2 Міцний гомеополярний зв’язок, в якому, окрім цього електрона, бере участь електрон кристалу, що переходить на локальний енергетичний рівень, який виникає в забороненій зоні кристалу внаслідок адсорбції. 3. Іонний зв’язок, що утворюється при переході валентного електрона адсорбованого атома в гратці кристалу. Найбільш реакційно здатні стани зі слабким зв’язком, оскільки вони характеризуються ненасиченими валентностями.
Вихідні молекули, взаємодіючи з вільними валентностями каталізатора, адсорбуються з утворенням вільних атомів або радикалів. Адсорбовані частинки, як показали розрахунки, постійно змінюють характер свого зв’язку з поверхнею каталізатора, що тісно пов’язаний з природою домішок в цьому каталізаторі.
Велику увагу в даний час приділяють каталізу комплексними сполуками. Відомо, що s – і p – рівні електронів зовнішньої оболонки перехідних металів близькі до d – рівня попередньої. Це полегшує електронні переходи і створення гібридних орбіталей різної орієнтації. Взаємодія атомів або іонів перехідного металу з іонами чи молекулами інших речовин веде до утворення комплексних сполук металу з одним або декількома лігандами, орбіталі яких перекриваються орбіталями центрального атома або іона металу. Міцність зв’язку даного ліганду залежить від останніх, одні зв’язки підсилюються за рахунок послаблення інших зв’язків.
Каталітична дія комплексних каталізаторів обумовлена включенням у координаційну сферу молекул реагентів з витісненням менш міцно зв’язаних лігандів. Каталітична реакція полегшується взаємною орієнтацією реагентів, їх поляризацією в полі центрального атома, полегшення електронних переходів внаслідок того, що в них бере участь центральний атом, зниження енергії активації і компенсації енергії розриву одних зв’язків з одночасним утворенням інших.
Гідрування етилену С2Н4 + Н2 → С2Н6, що включає стадії:
Н2 → 2Н•,
Н• + С2Н4 → С2Н5• 
С2Н5• + Н• → С2Н6
без каталізатора протікає повільно внаслідок більш важкого протікання першої стадії, що вимагає великих витрат енергії на розрив зв’язку у молекулі водню. Реакція каталізується комплексом родію, який позначимо для стислості ФМ, де М – метал, Ф – координаційна сфера. Першою стадією каталітичного процесу є приєднання водню
 Н
Н
 ФМ + Н2 → ФМ
ФМ + Н2 → ФМ
Н,
в якому розрив зв’язку Н – Н компенсується енергією утворення зв’язків атомів водню з металом. У наступних стадіях:
 Н
Н

 Н Н
Н Н
 ФМ + С2Н4 → ФМ Н → ФМ → ФМ + С2Н6
ФМ + С2Н4 → ФМ Н → ФМ → ФМ + С2Н6
 Н С2Н5
Н С2Н5
С2Н4
відбувається приєднання молекули етилену, перерозподіл зв’язків у складі координаційної сфери комплексу і виділення продукту і каталізатора.
Перевагою комплексних каталізаторів є зміна каталітичних властивостей при зміні лігандів. Це дозволяє досягти високої специфічності і вибірковості таких каталізаторів.
Комплексні сполуки можуть бути каталізаторами як в гомогенному, так і в гетерогенному каталізах. В останньому випадку вони закріплюються на поверхні якого-небудь носія. Такі гетерогенізовані каталізатори дозволяють уникнути складнощів, які можуть виникнути при відокремленні каталізатора від продуктів реакції, що притаманне гомогенному каталізу.
Можливі багатоядерні комплексні сполуки, що являють собою кластери, які містять декілька атомів перехідних металів, що зв’язані між собою. Зокрема, встановлено, що більшість ферментів окисно-відновних реакцій містять від 4 до 12 атомів металу, що створює “ координаційну клітку” для протікання реакції в обмеженому просторі і пояснює специфічну дію ферментів.
Ферментативний каталіз тісно пов’язаний з життєдіяльністю тварин і рослин. Всі життєво важливі процеси в організмах керуються органічними каталізаторами, що називаються ферментами або ензимами. Для ферментативного каталізу характерні висока специфічність, що досягається при невисоких температурах і тисках. У даний час ферменти все більше використовуються в промисловості.
Малу стабільність ферментів, що виділяють із органів тварин, рослин або культур мікробів, підвищують, здійснюючи так звану іммобілізацію ферментів. З цією метою ферменти вводять у середовище, в якому протікають процеси полімеризації. Після завершення процесів ферменти виявляються міцно закріпленими і довго зберігають каталітичну активність.
Висока каталітична активність і специфічність ферментів пояснюється злитним механізмом каталітичного процесу і складною будовою молекул ферментів з наявністю ряду адсорбційних центрів, що забезпечують оптимальну орієнтацію молекул реагентів по відношенню до каталітично активних груп ферментів. Молекули реагентів утворюють з активними центрами ферменту ланцюги перерозподілу зв’язків з одночасним спряженням декількох етапів хімічного перетворення і значною компенсацією енергії розриву старих зв’язків. Слід відмітити, що теорія ферментативних реакцій ще тільки створюється, а в механізмі дії ферментів багато незрозумілого.
Поиск по сайту: