 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Литературный обзор
Содержание
1. Введение……………………………………………………………………………………2
2. Литературный обзор………………………………………………………………..3
3. Золь-Гель синтез………………………………………………………………..…….6
3.1.Получение золя……………………………………………………………..……6
3.2.Гелеобразование……………………………..…………………………………9
3.3.Старение…………….………………………………………………………………11
3.4. Сушка………………………….………………………………………………………11
4. Применение……………………………………………………………………….………12
5. Заключение………………………………………………………………………….…….14
6. Список литературы…………………………………………………………….………15
Введение
Нанотехнология это совокупность методов, обеспечивающих возможность контролируемым образом создавать и модифицировать объекты которые включают в себя компоненты с размером 10-9м. Одним из таких методов является «Золь-Гель» синтез.
Золь-Гель синтез это синтез дающий возможность получения материалов с определенными химическими и физико-механическими свойствами, включающая получение золя и перевод его в гель. Переход золя в гель лежит в основе многих современных технологий, связанных с производством волокнистых материалов, стекол, покрытий, керамических мембран, пленок, термо и звукоизоляционных и пористых материалов, керамики, композиционных и лакокрасочных материалов и т.д.
Литературный обзор
Мы привыкли рассматривать вещества с двух позиций. С одной стороны это твердые вещества, жидкости и газы. С другой стороны микроскопическая структура этих веществ, т.е. атомы, ионы и молекулы. Между этими двумя пределами имеется область, к которой относятся частицы промежуточного размера. О веществах, относящихся к этой области, принято говорить, что они находятся в коллоидном состоянии. Особенность подобного состояния веществ заключается в том, что ему присущи свойства, не наблюдаемые ни у макроскопических объектов, ни у полностью диспергированных молекул. Например, от молекулярных растворов коллоидные могут быть отличены по их оптическим свойствам. Если через стакан с коллоидным раствором пропустить сильный пучок световых лучей, то в результате светорассеяния коллоидными частицами в нем образуется светлый конус, хорошо видимый в темном помещении. Напротив, поставленный в те же условия истинный раствор кажется «оптически пустым», т.к. содержащиеся в нем частички молекулярных растворов в заметной степени свет не рассеивают. Это явление называется эффект Тиндаля (рис. 1)[1]. С наличием светорассеяния связана также, часто наблюдаемая, опалисценция коллоидных растворов, т.е. их мутноватый вид в отраженном свете.

Рис. 1 Эффект Тиндаля
Дисперсная система с коллоидным размером частиц распределенных в той или иной среде носит название коллоидного раствора.
| Система | Название | Примеры |
| Жидкость диспергированная в газе | Аэрозоль | Туман, дымка |
| Твердое вещество диспергированное в газе | Аэрозоль | Дым пыль, смог |
| Газ диспергированный в жидкости | Пена | Газированные напитки, взбитые сливки |
| Жидкость диспергированная в жидкости | Эмульсии | Молоко, жидкие среды организма (плазма, кровь, лимфа) |
| Твердое вещество диспергированное в жидкости | Золь | Строительные растворы, пасты |
| Газ диспергированный в твердом веществе | Гель | Керамика, пенопласты, поролон, пористый шоколад |
| Жидкость диспергированная в твердом веществе | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) |
| Твердое вещество диспергированное в твердом веществе | Твердый золь | Цветные стекла, горные породы |
Табл. 1 Типы дисперсных систем.
На основании таблицы 1[2] можно убедиться, что дисперсные системы чрезвычайно многообразны. Можно сказать, что они составляют основу всего живого мира. Распространенность их в быту, в технике, в промышленности также велика. Большое значение коллоидные системы имеют для биологии и медицины. Одним из важнейших типов коллоидных систем являются золи и гели.
Золи – коллоидные растворы, в которых частицы дисперсной фазы (мицелы) свободны и участвуют в интенсивном броуновском движении и поэтому не оседают под действием силы тяжести.
Мицелла - частица дисперсной фазы золя, окруженная слоем молекул или ионов дисперсионной среды. Строение мицеллы показано на рис.2[5].
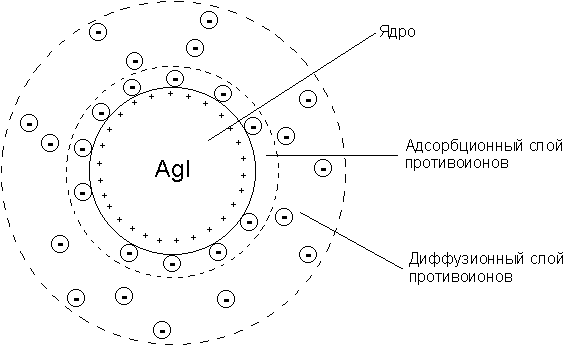
Рис.2 Строение мицеллы
Ядро мицеллы имеет значительный заряд и притягивает из раствора противоположно заряженные ионы (противоионы). Противоионы в мицелле образуют два слоя, которые различаются по силе их притяжения к ядру. Относительно плотный адсорбционный слой противоионов (в котором реализуется достаточно сильное электростатическое взаимодействие противоионов с зарядом ядра) и более удаленный от ядра диффузный слой («размытый») (в котором противоионы притягиваются к ядру намного меньше вследствие ослабления (экранирования) заряда ядра противоионами адсорбционного слоя). Противоионы адсорбционного слоя вместе с ядром образуют единую структуру относительно постоянного состава – коллоидную частицу.
Гели – дисперсные системы с жидкой или газообразной дисперсной средой и пространственной структурой (сеткой) дисперсной фазы. Такая сетка придает гелю свойства твердого тела. Гели обладают пластичностью, эластичностью и тиксотропными свойствами. Тиксотропия – способность восстанавливать свою первоначальную структуру после его механического разрушения, а также разжижается под действием интенсивных механических воздействий. Гели образуются из золей в результате молекулярного сцепления частиц дисперсной фазы.
Поиск по сайту: