 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Физические свойства
Единый государственный экзамен по химии - 2012 год.
Органическая химия. Кислородсодержащие органические соединения.
Классификация по качественному составу функциональных групп
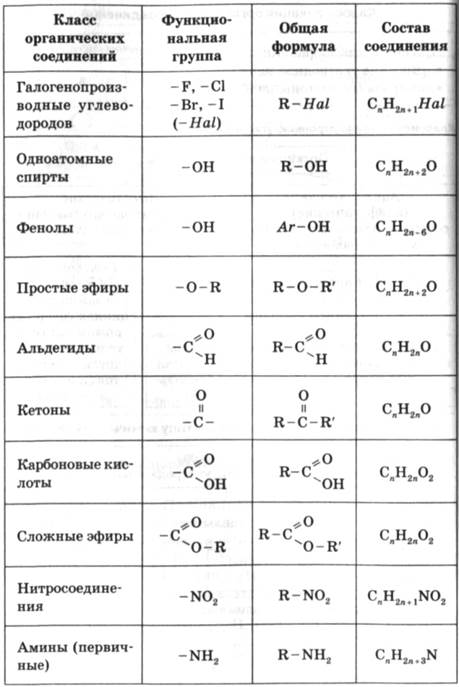
Названия основных функциональных групп

Спирты
Сложные органические соединения, где атом углерода замещён гидроксильной группой.
Предельные одноатомные
R – OH
СnH2n+1OH
CnH2n+2O
Многоатомные
R – C(OH) – C(OH)
Номенклатура
CH3OH – метиловый спирт, метан ол
С2H5OH – этиловый спирт, этан ол
С3Н7ОН – пропиловый спирт, пропан ол -1
CH3CH(OH)CH3– изопропиловый спирт, пропан ол -2
СН2(ОН)-СН2(ОН) – этиленгликоль, этанди ол
CH2(ОН)-CH(OH)-CH2(OH) – глицерин, пропантри ол
CH2(ОН)-CH(OH)- CH(OH)- CH(OH)- CH(OH)-CH2(OH) – сорбит, гексангекса ол
Алкоголяты - продукты замещения водорода гидроксильной группы спиртов.
(метил ат, этил ат)
Физические свойства
Кислотные свойства спирта выше, чем меньше там радикал, чем больше там галогенов.

сильный слабый
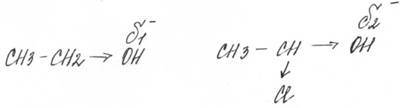
слабый сильный
Метанол – жидкость без цвета, прозрачная; сильно ядовитая; растворяется в воде
Этанол – жидкость без цвета, прозрачная; имеет специфический запах; неограниченно растворяется в воде.
Глицерин – жидкость без цвета; вязкая; гигроскопичная; сладкая на вкус
Изомерия
1.Структурная
а) углеродного скелета
б) положения функциональной группы
в) межклассовая (=простой эфир)
Химические свойства
Спирты – амфотерные соединения.
1. +Ме

2. Гидрогалогенирование

3. +HNO3 (H2SO4)
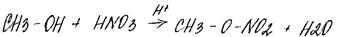
4.Этерификация

5.Дегидратация
- внутримолекулярная

- межмолекулярная

- синтез Лебедева
6.Окисление
- горение
- мягкое окисление (до альдегидов/кетонов)
первичные – до альдегидов
вторичные – до кетонов
третичные – не окисляются
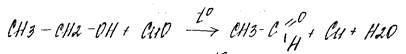

- жёсткое окисление (до карбоновых кислот)
7. +PCl5

8. +основание (! только для многоатомных спиртов)

! качественная реакция на многоатомные спирты (синий → тёмносиний)
Получение
1. Гидратация алкенов
2. Дегалогенирование моногалогеналканов

3.Гидрирование альдегидов
4. Синтез-газ

5.Брожение глюкозы

6. Мягкое окисление алкенов (для многоатомных)
Фенолы CnH2n-6O
Производные ароматических углеводородов, в которых один или несколько атомов водорода, непосредственно связанных с ароматическим кольцом, замещены гидроксильными группами.

фенол ароматический спирт
Номенклатура

фенол о-крезол (орто-метил-фенол)
Феноляты - продукты замещения водорода гидроксильной группы фенолов.
Физические свойства
кристаллическое вещество
имеет специфический запах (запах гуаши)
на воздухе краснеет вследствие окисления
плохо растворяется в холодной воде, при t > 60 °С — без ограничений
ядовит
антисептик (карболовая кислота)
Применение:
медицина
производство фенолформальдегидных пластмасс
производство лекарств, взрывчатых веществ, красителей
Изомерия
1.Структурная
а)положения заместителей в бензольном кольце
б)боковой цепи (строение и число радикалов)
Поиск по сайту: