 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ФАЗОВЫЕ РАВНОВЕСИЯ И ФАЗОВЫЕ ПЕРЕХОДЫ
План
Фазы вещества. Равновесие фаз. Фазовая диаграмма (диаграмма состояния). Тройная точка. Уравнение Клайперона – Клаузиуса.
Фазой называется макроскопическая физически однородная часть вещества, отделённая от остальных частей системы поверхностью раздела. Фазовое равновесие – одновременное существование фаз в многофазной системе (без изменения одной фазы за счет другой).
Три фазы одного и того же вещества (твёрдая, жидкая и газообразная или жидкая и две твёрдых или три твёрдых) могут находиться в равновесии только при единственных значениях температуры и давления, которые на диаграмме 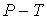 соответствует точка, называемая тройной.
соответствует точка, называемая тройной.
В термодинамике доказывается, что равновесие более чем 3-х фаз одного и того же веществаневозможно.
Диаграмма состояния.
1-2-3 переход кристалл  жидкость
жидкость  газ
газ
4-5 кристалл  газ
газ
6-7 переход из жидкости в газ без расслоения на фазы.
Сублимация (возгонка) – непосредственный (без плавления) переход из кристаллического состояния в газообразное.
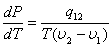
Уравнение Клапейрона – Клаузиуса
q12 - теплота фазового перехода, T - температура, v1 и v2 - объёмы обеих фаз.
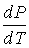 определяет наклон фазовой кривой фазового равновесия Р(Т). Уравнение Клапейрона – Клаузиуса даёт изменение температуры фазового перехода при изменении давления.
определяет наклон фазовой кривой фазового равновесия Р(Т). Уравнение Клапейрона – Клаузиуса даёт изменение температуры фазового перехода при изменении давления.
Лекция №7 (13)
Поиск по сайту: