 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Основания: определение, классификация, номенклатура, способы получения, химические свойства
Основания - сложные вещества, состоящие из атомов металла и одной или несколько гидроксогрупп(OH) 1)щелочи - растворимые в воде основания (NaOH, KOH) 2)нерастворимые основания (Cu(OH)2, Fe(OH)2) 3)-однокислотные (NaOH ),-двухкислотные (Ca(OH)2),- трехкислотные (Fe(OH)3)
Химические свойства В водных растворах основания диссоциируют, что изменяет ионное равновесие:  это изменение проявляется в цветах некоторых кислотно-основных индикаторов:,лакмус становится синим,,метилоранж — жёлтым,фенолфталеин приобретает цвет фуксии.
это изменение проявляется в цветах некоторых кислотно-основных индикаторов:,лакмус становится синим,,метилоранж — жёлтым,фенолфталеин приобретает цвет фуксии.
При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода: 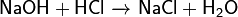 Примечание: реакция не идёт, если и кислота и основание слабые.
Примечание: реакция не идёт, если и кислота и основание слабые.
При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:  ,
, 
Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов: 
Основания реагируют с кислотными или амфотерными оксидами с образованием солей:  ,
, 
Основания вступают в обменные реакции (реагируют с растворами солей): 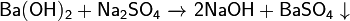
Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:  Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре. Основания щелочных металлов (кроме лития) при нагревании плавятся, расплавы являются электролитами.
Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре. Основания щелочных металлов (кроме лития) при нагревании плавятся, расплавы являются электролитами.
Получение: Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.  Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы. 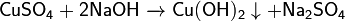 Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.
Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.  Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:  Некоторые основания можно получить реакциями обмена:
Некоторые основания можно получить реакциями обмена:  Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2.
Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2.
Поиск по сайту: