 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тема 11. Реальные газы. Явления переноса
Реальный газ – газ, где учитываются объем (размеры) и силы взаимодействия молекул. Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И.Ван-дер-Ваальс введя поправки в уравнение Менделеева-Клайперона, вывел уравнение состояния реального газа.
Уравнение состояния для 1 моля идеального газа имеет вид pV = RT
Согласно этой формуле объем газа при сжатии может стать равным нулю. В случае реальных газов часть объема занята самими молекулами. Поэтому объем, занимаемый газом, должен быть уменьшен на величину b, где b - объем занимаемый самими молекулами, т.е. (V-b). Таким образом, b –постоянная величина, учитывающая объемы (размеры) молекул.  В реальных газах имеются силы взаимного притяжения молекул, которые действуют дополнительно к силам внешнего давления и как бы сжимают газ. Вследствие этого возникает добавочное внутреннее давление pi, т.е.
В реальных газах имеются силы взаимного притяжения молекул, которые действуют дополнительно к силам внешнего давления и как бы сжимают газ. Вследствие этого возникает добавочное внутреннее давление pi, т.е.
где (p + pi), а – постоянная величина, учитывающая
силы межмолекулярного притяжения
 Тогда, введя поправки на V и p, получим уравнение состояния реального газа
Тогда, введя поправки на V и p, получим уравнение состояния реального газа
- уравнение Ван-дер-Ваальса для 1 моля газа
Величины a и b для различных газов различны и их значение приводятся в справочных таблицах.
 Для любой массы газа
Для любой массы газа
Уравнение Ван-дер-Ваальса не единственное уравнение, описывающее реальные газы. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса – кривые зависимости давления p от объема V при заданных температурах Т, определяемые уравнение Ван-дер-Ваальса для 1 моля газа.
Эти кривые рассматриваются для четырех различных температур и имеют своеобразный характер.
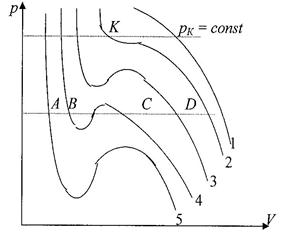
| Задавая различные температуры T1 > T2 > T3 > T4 > T5 получим семейство изотерм Ван-дер-Ваальса. При высоких температурах изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы. Изобара AD пересекает изотерму в одной точке. Это означает, что каждому значению давления и температуры |
соответствует единственное значение объема, т.е. при высоких температурах вещество находится в однофазном – газообразном состоянии. Невысоким температурам соответствуют изотермы 2-, 3-, 4, на которых имеются изгибы.
Изобара AD пересекает изотерму 4 в трех точках А, В, С. Это означает, что вещество одновременно находится в трех фазовых состояниях. Переход от изотермы 5 к изотермам 4,3,2,1, соответствующий повышению температуры, приводит к тому, что изгибы на изотермах сглаживаются. Расстояние между точками А и С уменьшаются и на изотерме 2 сливаются в одну точку К. Здесь рК = const является касательной к изотерме. Эта изотерма называется критической, соответствующая температура Тк – критической, точка К – критической. Соответствующие этой точке VK и рК – называются критическими.
Состояние с критическими параметрами (VK,,рК,,ТК) называются критическим состоянием.
Температурам, выше критическим соответствует только газообразное состояние вещества. Следовательно, критическая температура ТК – это наивысшая температура, при которой газ может еще может быть превращен в жидкость. При критическом состоянии вещества различия в свойствах пара и жидкости отсутствуют. Критические состояния характеризуется непрерывным переходом пара в жидкость и жидкости в пар.
Мы знаем, что U = U1 + U2 = Eк + Eр.
 В случае реального газа, помимо кинетической энергии Ек нужно учитывать потенциальную энергию Ер взаимодействия молекул.
В случае реального газа, помимо кинетической энергии Ек нужно учитывать потенциальную энергию Ер взаимодействия молекул.
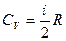 Внутренняя энергия для 1 моля идеального газа
Внутренняя энергия для 1 моля идеального газа
 Так как, то
Так как, то
Работа сил молекулярного сцепления равна: dA = pi dV,
 |
Мы знаем, что
Тогда dU которое произошло за счет совершения работы
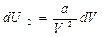 или интегрируя, получим:
или интегрируя, получим:
 |
- потенциальная энергия
 |
Тогда - внутренняя энергия 1 моля реального газа.
Следовательно, внутренняя энергия реального газа зависит как от температуры, так и от его объема.
В термодинамически неравновесных системах возникают особые необратимые процессы – явления переноса – в результате которых происходит пространственный перенос энергии, массы, импульса.
К явлениям переноса относятся:
1. Теплопроводность обусловлена переносом энергии (горячий чай – холодная ложка). Если в одной области Ек молекул больше, чем в другой, то в процессе столкновений молекул с течением времени происходит выравнивание кинетической энергии, т.е. температур.
Перенос энергии в форме теплоты подчиняется закону Фурье 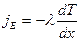
jE – плотность теплового потока – энергия, переносимая в форме теплоты через единицу площади в единицу времени, перпендикулярную оси х.
 - коэффициент теплопроводности
- коэффициент теплопроводности 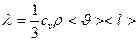
 – градиент температуры – изменение температуры на единицу длины. «-» - при теплопроводности энергия переносится в направлении убывания температуры.
– градиент температуры – изменение температуры на единицу длины. «-» - при теплопроводности энергия переносится в направлении убывания температуры.
2. Диффузия - самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и твердых тел.
Явление диффузии подчиняется закону Фика

jm – плотность потока массы – масса вещества, диффундирующего в единицу времени через единицу площади, перпендикулярную оси х
D – коэффициент диффузии
 - градиент плотности, «-» показывает, что перенос массы происходит в направлении убывания плотности.
- градиент плотности, «-» показывает, что перенос массы происходит в направлении убывания плотности.
Согласно кинетической теории газов 
3. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, а движущегося медленнее – увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее. Сила трения между слоями подчиняется закону Ньютона
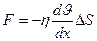
Тогда от одного слоя к другому передается импульс, по модулю равный действующей силе 
jp – плотность потока импульса – величина, определяемая полным импульсом, переносимым в единицу времени в положительном направлении оси х через единичную площадку, перпендикулярную оси х.
 - градиент скорости, «-» - указывает, что импульс переносится в направлении убывания скорости.
- градиент скорости, «-» - указывает, что импульс переносится в направлении убывания скорости.
Динамическая вязкость определяется по формуле

Коэффициенты переноса связаны между собой соотношениями
 и
и 
Поиск по сайту: