 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Общая характеристика. При рассмотрении химических свойств ацетиленовых углеводородов следует учитывать особенности ацетиленовой связи
При рассмотрении химических свойств ацетиленовых углеводородов следует учитывать особенности ацетиленовой связи. Эти особенности ацетиленовой группировки объясняются ее квантово-химическим строением. Оба углеродных атома в ацетилене находятся в sp – гибридном состоянии. Электронная формула для углерода в возбужденном состоянии запишется так:
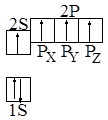
На внешнем электронном уровне четыре электрона, имеющие различные формы орбитали. В ацетилене осуществляется гибридизация одной 2s орбитали и одной 2-px атомной орбитали у каждого атома углерода. Две атомные 2ру и 2рz орбитали сохраняются неизменными.
В то время как атомная s-орбиталь не имеет направленного характера,
р-орбиталь обладает направленностью по оси рх в разные стороны от углеродного ядра атома С, образуя две связи, угол между которыми равен 1800.
 | |||
 | |||
Остаются незатронутым гибридизацией две р-орбитали, расположенные во взаимноперпендикулярных направлениях, которые при боковом перекрывании с двумя р-орбиталями образуют 2П – связи.

Химическое поведение алкинов в синтезах обусловлено, с одной стороны, тем, что тройная связь вступает в реакции электрофильного и, реже, нуклеофильного присоединения и, с другой стороны,тем, что водород, соединенный с ацетиленовой группой, обладает кислыми свойствами и может замещаться при действии сильных оснований с образованием ацетиленидов.
Кислые свойства ацетиленовых углеводородов невелики по сравнению с минеральными кислотами, но их кислотность в 1018 раз больше, чем кислотность водорода в алканах.
Константа диссоциации Ка
Н2О 10-16
НСºСН 10-22 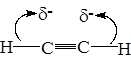
СН3 –СН3 10-40
Причиной кислых свойств ацетилена является сильная поляризация связи С-Н благодаря тому, что в sp гибридной форме углеродный атом (ядро) значительно сильнее удерживает электроны, чем в sp2 и sp3 гибридизации. Доля s орбиталей соответствует 50 %, а в sp3 всего 25%, а радиус s орбитали относится к радиусу р орбитали как 1:1,73. Таким образом, чем большим s и меньшим р- характером обладает sp -гибридизованная орбиталь, тем в большей степени форма этой орбитали приближается к сферической и электроны плотнее удерживаются ядром.
Алкины могут вступать в реакции присоединения Аde,Adr – редко, кроме того возможны реакции замещения, полимеризации, изомеризации и окисления.
5.2. Реакции присоединения
Тройная связь по реакционной способности похожа на двойную связь, но не превосходит ее по активности. Присоединения, характерные для кратных связей, в случае тройной связи происходят в две ступени.
5.2.1.Присоединения водорода (реакции гидрирования)
Водород в момент выделения не взаимодействует с тройной связью так же как и с двойной связью, но газообразный водород в присутствии катализатора восстанавливает алкины сразу до алканов.
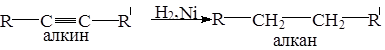
Можно осуществить и первую ступень этой реакции, если взять менее активный катализатор Pd (отрав) PbCO3 при гидрировании получаются цис-алкены, а при восстановлении Na, Li в NH3 транс-алкены (реакция была приведена ранее).

5.2.2.Присоединение галогенов
Реакция протекает в две стадии. Реакция с Br2 является качественной реакцией на двойную и тройную связь. Энергично протекает первая стадия (транс, присоединение).
Скорость реакции уменьшается от Cl2 к J2; 
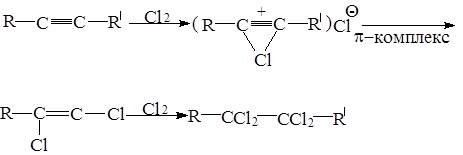
5.2.3.Присоединение галогеноводородов
Реакция идет в две стадии по правилу Марковникова.
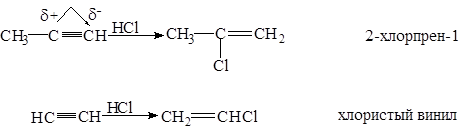
Один из способов промышленного получения хлористого винила.
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
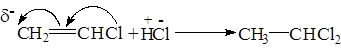
5.2.4. Присоединение воды
Реакция гидратации происходит в присутствии катализатора Hg2+ в кислой среде.Ацетилен присоединяет воду в соответствии с правилом Марковникова.

Подобное взаимное превращение енола в альдегид или кетон происходит по правилу Эльтекова. Из гомологов ацетилена получают кетоны.
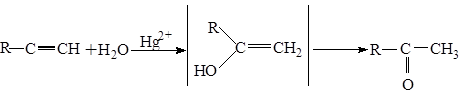
Первая реакция была открыта М.Г. Кучеровым и используется в промышленности для получения ацетальдегида, который затем превращают в уксусную кислоту (А.Е. Фаворский, М.Ф. Шостаковский).
5.2.5.Присоединение спиртов
При каталитическом воздействии КОН под давлением ацетилен и его гомологи присоединяются к спиртам с образованием простых алкил-виниловых эфиров.
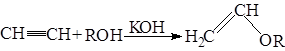
Реакция осуществляется в промышленности для получения полимеров.
5.2.6. Присоединение карбоновых кислот
В условиях гетерогенного катализа ацетилен присоединяет уксусную кислоту, образую сложный виниловый эфир (винилацетат) – важный исходный продукт для полимеризации в поливинилацетат, гидролизируемый в поливиниловый спирт.

5.2.7. Присоединение трихлористого мышьяка
идет в присутствии катализаторов HgCl2, AlCl3 и др. в две стадии.
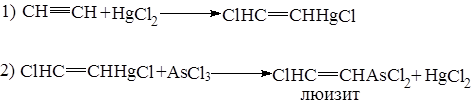
b-хлорвинилдихлорарсин (люизит) – ОВ кожно-нарывного действия.
|
 |
 HCºCH+H-C ºN H2C=C-CºN
HCºCH+H-C ºN H2C=C-CºN
Это один из трех промышленных способов получения акрилонитрила (искусственной шерсти).
5.3. Кислые свойства алкинов
Водородные атомы легко подвергаются протонизации, о чем было сказано раньше. При взаимодействии ацетилена с аммиачным раствором окиси серебра или полухлористой меди выпадает осадок нерастворимых ацетиленидов серебра AgCºCAg (белый цвет) и CuCºCCu ацетилениды меди – вишнево-бурого цвета. Эти ацетилениды взрывчаты.
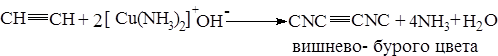
Эта реакция является качественной на ацетилен (используется для обнаружения люизита). Раствор металлического натрия в жидком аммиаке также замещает подвижные атомы водорода в ацетилене.
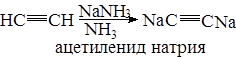
5.4. Реакция окисления
Ацетеленовые углеводороды легко окисляются при действии окислителей. Раствор KMnO4 обесцвечивается при прохождении в него ацетилена. Это может так же служить качественной реакцией на СºС связь. При поджигании горят.
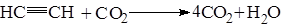
5.5. Реакция полимеризации
Исключительно важны реакции полимеризации ацетилена:
ацетиленовые углеводороды способны полимеризоваться в нескольких направлениях.
а) при нагревании в присутствии активированного угля (Н. Д. Зелинский) или лучше в присутствии Ni(CO)4, [(C6H5)3 P]2
ацетилен образует бензол: (В. Peппe.)
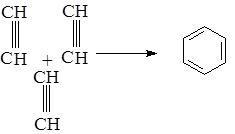
б) под действием комплексных солей меди происходит линейная полимеризация с образованием винилацетилена (I) и дивинилацетилена (2).
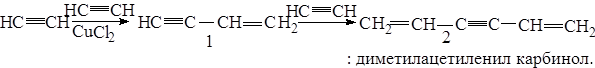
в) при действии на ацетилен комплексным соединением никеля образуются циклические соединения с большим числом углеродных атомов, чем в бензоле. (B. Peппe.)
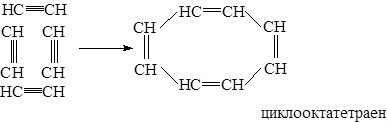
Все эти процессы имеют практическое значение.
5.6. Реакции конденсации
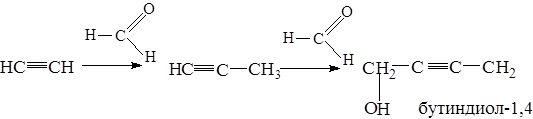
Реакция Фаворского – конденсация ацетилена с ацетоном в абсолютном эфире, в присутствии сухого порошкообразного KOH:
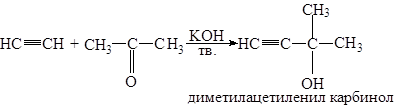
Ацетилен является ценным исходным веществом для многих промышленных синтезов: C2H5OH, CH3CHO, CH3COOH.
синтетических каучуков (изопреновой, хлорпреновой пластмасс), волокон (нейлон, нитрон), инсектицидов, отравляющих веществ, растворителей, красителей и т.д.
Поиск по сайту: