 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
СПОСОБЫ ИЗМЕНЕНИЯ ВНУТРЕННЕЙ ЭНЕРГИИ
Внутреннюю энергию можно изменить двумя способами.

Если работа совершается над телом, его внутренняя энергия увеличивается.

Если работу совершает само тело, его внутренняя энергия уменьшается.
Первый закон термодинамики:
дельта U = Q +A
1) Изменение внутренней энергии при переходе системы из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
2) Количество теплоты, переданное системе, идет на изменение внутренней энергии и работу системы над внешними телами.
Q = дельта U + A со штрихом
Применение:
1. Изохорный процесс.
V - const, A штрих = 0,
Q = дельта U.
2. Изотермический процесс.
T - const,
Q = A штрих
3. Изобарный процесс.
p - const,
Q = дельта U + A штрих
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:

| (4.2.1) |
Размерность теплоемкости: [ C ] = Дж/К. Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [ Cуд ] = Дж/К.
Для газов удобно пользоваться молярной теплоемкостью Cμ - количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
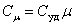
| (4.2.2) |
[Cμ] = Дж/(моль×К).
Из п. 1.2 известно, что молярная масса – масса одного моля:

|
где А – атомная масса; mед - атомная единица массы; NА - число Авогадро; моль μ – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода 12С.
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV.
СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2).

Рис. 4.2
Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что  .
.
Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния.
Величины СР и СV оказываются связанными простыми соотношениями. Найдём их. Пусть мы нагреваем один моль идеального газа при постоянном объёме(d A = 0). Тогда первое начало термодинамики запишем в виде:
 , ,
| (4.2.3) |
т.е. бесконечно малое приращение количества теплоты  равно приращению внутренней энергии d U.
равно приращению внутренней энергии d U.
Теплоемкость при постоянном объёме будет равна:
 , ,
| (4.2.4) |
В общем случае
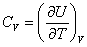 , ,
|
так как U может зависеть не только от температуры. Но в случае идеального газа справедлива формула (4.2.4).
Из (4.2.4) следует, что 
 , ,
|
 , ,
| (4.2.5) |
Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных), поэтому формула (4.2.5) справедлива для любого процесса. Для произвольной идеальной массы газа:
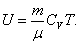 , ,
| (4.2.6) |
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
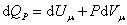 . .
|
 . .
| (4.2.7) |
Из основного уравнения молекулярно-кинетической теории 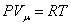 . При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим:
. При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим:
 . .
| (4.2.8) |
Это уравнение Майера для одного моля газа.
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей:
 . .
|
или
 . .
| (4.2.9) |
Адиабатный процесс - это процесс, идущий в абсолютно теплоизолированной системе. При таком процессе если совершается работа со стороны тела, то исключительно за счет его внутренней энергии - температура его понижается. Если же совершается работа над телом, то его температура поднимается... Идальный газ - это газ, в котором: 1) размеры молекул пренебрежимо малы по сравнению с межмолекулярными расстояниями, и 2) молекулы взаимодействуют лишь при непосредственном соударении между собой, которое представляет собой абсолютно упругий удар.
Хотя идеального адиабатного (адиабатического) процесса в природе не существует, но многие процессы с большой точностью можно считать таковыми. Например, процесс, происходящий с молекулами материала поковки, когда по ней ударит молот; или же процесс сжатия рабочей смеси в цилиндрах современных быстроходных автомобилей. То же самое можно сказать об идеальном газе: водород, кислород, азот, углекислый газ... многие газы с очень большой точностью принимаются за идеальные газы и к ним применяются известные законы для идеального газа.
Процесс без обмена теплотой с окружающей средой называется адиабатическим. Он может происходить, если газ (или другое тело) окружен абсолютно не проводящей тепло оболочкой или процесс происходит очень быстро, так что газ не успевает обменяться теплом с другими телами.
При таких процессах первое начало термодинамики упрощается:
δQ = 0; dU = – δА. (32).
Это означает, что если над газом производить работу ( δ А < 0), то dU > 0. Внутренняя энергия газа возрастает, он нагревается. Если же газ расширяется, то он сам производит работу δ А > 0 за счет собственной внутренней энергии и dU < 0. В результате он охлаждается.
Согласно (25): dU =ν · CV · dT. Дляδ А используем соотношение (20). Тогда выражение (32) для адиабатического процесса можно записать так:
 (33).
(33).
Подставим сюда р из уравнения Клапейрона-Менделеева (4) иполучим:
 ;
;  (34).
(34).
Проинтегрируем последнее выражение для пределов изменения переменных от T 1 до T 2 и от V 1 до V 2 и введя обозначение  (35). получим:
(35). получим:  (36),
(36),
а используя Т = p·V/(ν·R), получаем  (37).
(37).
Соотношения (36-37) носят название уравнений Пуассона или адиабаты. γ – показатель адиабаты.
 Поскольку γ > 1, давление в (37) обратно пропорционально не V, как было при изотермическом процессе, а Vγ, т. е. давление убывает с увеличением объема быстрее. На рисунке a кривые 1 и 2 – изотермы (Т 2 < T 1), а кривая 3 – адиабата.
Поскольку γ > 1, давление в (37) обратно пропорционально не V, как было при изотермическом процессе, а Vγ, т. е. давление убывает с увеличением объема быстрее. На рисунке a кривые 1 и 2 – изотермы (Т 2 < T 1), а кривая 3 – адиабата.
При любых других процессах (неизотермических и неадиабатических) всегда можно связь между р и V написать в виде (37), но γ уже не будет равна Ср/СV.
В этих случаях процесс называется политропическим, а γ – показателем политропы.
Можно сказать, что для изотермического (T =const) процесса γ = 1, для изобарического (р = const) γ = 0, для изохорического (V = const) γ = ∞. На рисунке б показаны различные процессы расширения газа: 1 – изотерма, 2 – адиабата, 3 – изохора, 4 – изобара, 5 – политропа. Процессы 2, 3 идут с охлаждением, а 4, 5 – с нагреванием газа
Поиск по сайту: