 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Работа газа и его теплоёмкость в изопроцессах
Работу газа, совершаемую при изопроцессах, можно найти следующим образом: При изобарном процессе ( ):
):
 ;
;
При изохорном процессе ( ):
):
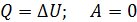 ;
;
При изотермическом процессе (
 ):
):
 ;
;
При адиабатном процессе ( ):
):
 , где
, где  - теплоёмкость газа при постоянном объёме.
- теплоёмкость газа при постоянном объёме.
Теплоемкость газа — это отношение тепла, сообщенного газу, к изменению температуры  , которое при этом произошло.
, которое при этом произошло. 
Молярная теплоемкость — теплоемкость 1 моля газа. 
Теплоемкость идеального газа в изопроцессах:
Адиабатический. В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть  . При изменении объема температура и давление меняются, то есть. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю:
. При изменении объема температура и давление меняются, то есть. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю:  .
.
Изотермический В изотермическом процессе постоянна температура, то есть 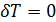 . При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности:
. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности: 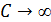 .
.
Изохорный В изохорическом процессе постоянен объем, то есть  . Таким образом,
. Таким образом,  где
где  число степеней свободы частиц газа.
число степеней свободы частиц газа.
Изобарный В изобарном процессе  :
: 
Полезные формулы:
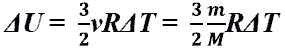
Изменение внутренней энергии
идеального одноатомного газа.
 Количество теплоты, переданное телу,
Количество теплоты, переданное телу,
идет на изменение его внутренней энергии
и на совершение им работы (Первый закон термодинамики).
 Количество теплоты при нагревании и охлаждении газа.
Количество теплоты при нагревании и охлаждении газа.
 Работа газа при изобарном процессе (p = const)
Работа газа при изобарном процессе (p = const)
 22,Закон сохранения энергии в изо- и адиабатном процессах.
22,Закон сохранения энергии в изо- и адиабатном процессах.
Закон сохранения энергии в изо- и адиабатном процессах и есть первое начало термодинамики. Оно гласит о том, что кол-во теплоты газа равна сумме работы, которую совершил газ и изменению внутренней энергии газа.

Или для бесконечно малых величин:

Этот закон применим для каждого изопроцесса:
1. Изотермический процесс (T=const)
dU=0
отсюда:  – вся теплота расходуется на совершение работы.
– вся теплота расходуется на совершение работы.
 ;
; 
2. Изохорный процесс (V=const)
dV=0; dA=0
 – вся подводимая теплота идёт во внутреннюю энергию.
– вся подводимая теплота идёт во внутреннюю энергию.
 – молярная теплоёмкость;
– молярная теплоёмкость;  – удельная теплоёмкость
– удельная теплоёмкость
3. Изобарный процесс (P=const)


 – здесь полностью выполняется 1ое начало ТД.
– здесь полностью выполняется 1ое начало ТД.
4. Адиабатный процесс (Q=0)

 – газ совершает работу
– газ совершает работу
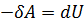 – над газом совершают работу
– над газом совершают работу

Поиск по сайту: