 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тепловой взрыв в неадиабатических условиях
В реальных системах всегда происходят потери теплоты за счет теплопроводности через стенки, конвекции, излучения и т.д. При этом экзотермическая реакция будет либо ускоряться, приводя к взрыву, либо протекать с постоянной скоростью при постоянной температуре T = const, определяемой тепловым балансом системы. Так, в частности, протекают экзотермические реакции горения в газовых печах, котельных топках и других теплотехнических агрегатах.
При наличии тепловых потерь уравнение (2.2) примет вид
 , (2.5)
, (2.5)
где V – объем реактора;
S – площадь поверхности стенок реактора;
Tс – температура стенок реактора;
α – коэффициент теплопередачи.
Первое слагаемое в правой части уравнения (2.5) описывает скорость выделения тепла в системе за счет химической реакции. Второе слагаемое – скорость отвода тепла за счет теплопроводности стенок, которая линейно зависит от температуры реагирующей смеси. Скорость притока тепла растет по степенному закону с ростом начальной концентрации компонентов 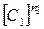 ,
,  и экспоненциально растет с ростом температуры T в соответствии с законом Аррениуса.
и экспоненциально растет с ростом температуры T в соответствии с законом Аррениуса.
Обозначим через  . Графики зависимости скорости тепловыделения Q+ и скорости теплопотерь Q- от температуры Т приведены на рис. 2.8 для трех значений D:
. Графики зависимости скорости тепловыделения Q+ и скорости теплопотерь Q- от температуры Т приведены на рис. 2.8 для трех значений D:
D1 > Dкр > D2.
Из анализа приведенных графиков, которые представляют собой диаграмму Семенова, следует, что при D = D1, кривые Q+, Q- не имеют точек пересечения; при D = Dкр, кривые Q+, Q- имеют одну точку касания; при D = D2, кривые Q+, Q- имеют две точки пересечения.
В первом случае (D = D1) скорость тепловыделения всегда превышает скорость теплопотерь, и в системе обязательно произойдет тепловой взрыв, так как температура смеси будет неограниченно возрастать.
Второй случай (D = Dкр), когда имеет место касание кривых тепловыделения и теплопотерь, определяет максимальное значение концентрации реагентов (параметра D), при котором скорость тепловыделения равна скорости теплопотерь.

Рис. 2.8. Влияние температуры неадиабатической системы на скорость тепловыделения и скорость теплопотерь
Все остальные кривые Q+ для более низких значений концентрации реагентов пересекают кривую Q- дважды. Причем, устойчивому состоянию системы отвечает только нижняя точка с более низкой температурой Туст.
Таким образом, если концентрация реагентов не превышает определенного критического для данной системы значения, то температура реагирующей смеси в реакторе будет постоянной T = Туст = const, причем Туст > Тс. При выполнении этого условия после некоторого переходного периода в химическом реакторе устанавливается стационарный режим, при котором скорость экзотермической реакции будет иметь постоянное значение u = const.
На рис. 2.9 приведены три режима работы реактора в виде зависимости температуры от времени T = f(t).

Рис. 2.9. Режимы работы реактора
Температура Т2 соответствует максимальной температуре в реакторе, при которой возможно устойчивое протекание химической реакции (при заданных значениях С1, С2, Тс). Можно показать, что величина Т2 определяется формулой
 .
.
Температура Т2 связана с параметрами реактора следующим соотношением:
 .
.
Это уравнение позволяет определить взрывобезопасность каждого конкретного реактора.
Обозначим
Z1 =  ,
,
Z2 =  .
.
Если Z2 << Z1, то реактор взрывобезопасен, если Z2» Z1, то ситуация является критической, то есть можно ожидать взрыва; при Z2 > Z1 в реакторе обязательно произойдет тепловой взрыв.
Для расчета давления в реакторе по известной скорости роста температуры dT/dt используется уравнение состояния (уравнение Менделеева-Клапейрона)
 ,
,
где p, r, T, R – давление, плотность, абсолютная температура и газовая постоянная продуктов сгорания в реакторе. Газовая постоянная продуктов сгорания R рассчитывается по формуле
R = cp – cv,
где cp, cv – удельные теплоемкости продуктов сгорания при постоянном давлении и постоянном объеме, соответственно.

Поиск по сайту: