 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
Приведем краткие сведения из химической кинетики – науки о механизме и скорости химических реакций. Важнейшая величина – скорость химической реакции – определяется изменением во времени количества какого-либо из исходных веществ или продуктов реакции в результате химического превращения. Химические реакции могут протекать гомогенно (в объеме одной фазы) или гетерогенно (на поверхности раздела фаз). Скорость гомогенной реакции – это количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема. Для реакций, протекающих в системах постоянного объема
 ,
,
где  – концентрация i -го вещества,
– концентрация i -го вещества,  или
или 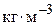 ;
;
 – скорость реакции по i -му веществу,
– скорость реакции по i -му веществу,  или
или 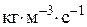
Если i -е вещество – продукт реакции, то  , если это исходное вещество, то
, если это исходное вещество, то  . Химические реакции делятся на простые и сложные. Простая реакция протекает в одном направлении и в один этап; кинетическая схема такой реакции имеет вид
. Химические реакции делятся на простые и сложные. Простая реакция протекает в одном направлении и в один этап; кинетическая схема такой реакции имеет вид
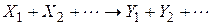 ,
,
где  – исходные вещества;
– исходные вещества;  – продукты реакции.
– продукты реакции.
К сложным относятся обратимые реакции (одновременно протекающие в двух противоположных направлениях)
 ,
,
параллельные реакции, описываемые, в частном случае кинетической схемой


и последовательные реакции, например

Для простой реакции можно записать стехиометрическое уравнение
 ,
,
где  – стехиометрические коэффициенты, соответственно равные числам молекул исходных веществ и продуктов реакции, участвующих в элементарном процессе. Стехиометрическое уравнение позволяет установить связь между скоростями простой реакции по различным компонентам:
– стехиометрические коэффициенты, соответственно равные числам молекул исходных веществ и продуктов реакции, участвующих в элементарном процессе. Стехиометрическое уравнение позволяет установить связь между скоростями простой реакции по различным компонентам:
 ;
;  ; …;
; …;  ;
;  …
…
При квазистационарном протекании процесса все исходные вещества должны исчезать, а продукты – появляться в результате химической реакции в эквивалентных количествах, то есть должно удовлетворяться условие стехиометрии:
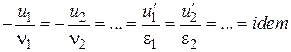 .
.
Чем больше величина  или
или  , тем больше по модулю должна быть скорость реакции
, тем больше по модулю должна быть скорость реакции 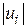 или
или  (то есть при большем значении стехиометрического коэффициента большее количество соответствующего вещества реагирует в единицу времени). Отсюда следует, что независимо от выбора вещества, скорость реакции можно охарактеризовать величиной
(то есть при большем значении стехиометрического коэффициента большее количество соответствующего вещества реагирует в единицу времени). Отсюда следует, что независимо от выбора вещества, скорость реакции можно охарактеризовать величиной
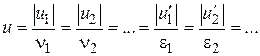 .
.
Величина  называется скоростью простой реакции без отношения к какому-либо конкретному компоненту.
называется скоростью простой реакции без отношения к какому-либо конкретному компоненту.
Скорость простой реакции подчиняется закону действующих масс
 ,
,
где k – константа скорости реакции, численно равная ее скорости при единичных концентрациях.
Подчеркнем, что в это уравнение входят только концентрации исходных веществ в степени их стехиометрических коэффициентов.
Сумма стехиометрических коэффициентов  , равная количеству молекул, принимающих участие в единичном акте, называется стехиометрическим порядком (молекулярностью) реакции:
, равная количеству молекул, принимающих участие в единичном акте, называется стехиометрическим порядком (молекулярностью) реакции:
 – мономолекулярная реакция;
– мономолекулярная реакция;
 – бимолекулярная реакция;
– бимолекулярная реакция;
 – тримолекулярная реакция.
– тримолекулярная реакция.
Стехиометрический порядок простой реакции – всегда целое число (не дробное) и не превышает трех (вероятность одновременного столкновения более чем трех молекул близка к нулю). Применять закон действующих масс для расчета сложных реакций можно для одностадийной обратимой реакции, скорость которой
 ,
,
где  ,
,  – скорости реакции в прямом и обратном направлениях. По закону действующих масс
– скорости реакции в прямом и обратном направлениях. По закону действующих масс

где  ,
,  – константы скорости прямой и обратной реакций. При
– константы скорости прямой и обратной реакций. При 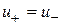 величина u = 0, что соответствует химическому равновесию системы.
величина u = 0, что соответствует химическому равновесию системы.
В общем случае для описания сложной реакции нужно несколько стехиометрических уравнений. Складывая их, получаем брутто-уравнение реакции, которое описывает процесс в целом, но не отражает истинного механизма химических превращений. Для сложной реакции можно (на основе экспериментов) записать уравнение, связывающее скорость реакции с концентрацией исходных веществ (кинетическое уравнение)
 ,
,
где  – порядок реакции по i -му веществу;
– порядок реакции по i -му веществу;  – порядок реакции (кинетический порядок реакции). В отличие от
– порядок реакции (кинетический порядок реакции). В отличие от  ,кинетический порядок реакции n может быть дробным числом. Размерность константы скорости реакции k зависит от ее порядка:
,кинетический порядок реакции n может быть дробным числом. Размерность константы скорости реакции k зависит от ее порядка:
для  ,
,  ;
;
для  ,
,  ;
;
для  ,
,  ,
,
где  – принятая размерность концентрации.
– принятая размерность концентрации.
Различие в размерности константы скорости реакции  связано с тем, что размерность скорости реакции всегда должна быть
связано с тем, что размерность скорости реакции всегда должна быть  или
или  .
.
Скорость подавляющего большинства реакций (простых и сложных) повышается с ростом температуры Т, а константа скорости реакции подчиняется закону Аррениуса
 ,
,
где z – предэкспонент (предэкспоненциальный множитель, частотный фактор), размерность которого равна размерности константы скорости реакции [ z ]=[ k ];
Т – абсолютная температура, К;
E – энергия активации реакции, Дж×моль-1;
R0 = 8.3134 Дж×К-1×моль-1 – универсальная газовая постоянная.
Безразмерный показатель экспоненты в законе Аррениуса называется критерием Аррениуса:
 ,
,
где  – характерная температура.
– характерная температура.
Этот критерий выражает чувствительность скорости химической реакции к изменению температуры. Чем выше значение Arn, тем сильнее эта чувствительность. Входящие в закон Аррениуса величины z и E называются кинетическими константами химической реакции. Физический смысл энергии активации Е для простой реакции состоит в том, что это энергия, которой должна обладать молекула для того, чтобы вступить в реакцию. Для сложных реакций Е не имеет простого физического смысла. Значения z, Е определяются, как правило, экспериментальным путем. Кинетические константы полностью определяют скорость протекания каждой конкретной реакции, в том числе и реакции воспламенения или горения. Задача экспериментального определения этих констант является важнейшей при исследовании физико-химических процессов в высокоэнергетических установках.
Химическая реакция проходит с выделением тепла (экзотермическая реакция), либо с его поглощением (эндотермическая реакция). Если прямая реакция – экзотермическая, то обратная – эндотермическая. Количество тепла, выделяемого при полном реагировании единицы количества вещества (1 моль или 1 кг), называется тепловым эффектом реакции  . Размерность теплового эффекта реакции
. Размерность теплового эффекта реакции  или
или  .
.
Поиск по сайту: