 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
СОСТАВ АТМОСФЕРНОГО ВОЗДУХА
Поскольку воздух является одним из основных компонентов горючей смеси, приведем данные по его характеристикам. Состав атмосферного воздуха достаточно сложен. Кроме основных компонентов – кислорода О2 и азота N2, в нем содержатся инертные газы (аргон, неон, гелий, криптон, ксенон), озон О3, углекислый газ СО2, пары воды H2O и частицы аэрозолей (пыль). Однако объем второстепенных компонентов в сухом очищенном воздухе не превышает 1%. Поэтому будем считать, что воздух состоит из двух компонентов – кислорода и азота. Характеристики этих газов при нормальных физических условиях приведены в табл. 4.1.
Таблица 4.1
Характеристики воздуха при нормальных физических условиях
| Газ | Состав | М | r, кг/м3 | R, Дж/(кг×К) | V M, м3/кмоль | |
| масс. % | объем. % | |||||
| Кислород | О2 | О2 | 32.00 | 1.429 | 259.7 | 22.393 |
| Азот | N2 | N2 | 28.013 | 1.251 | 296.65 | 22.395 |
| Воздух | 23% О2 77% N2 | 21% О2 79% N2 | 28.96 | 1.293 | 281.53 | 22.398 |
Под нормальными физическими условиями понимаются следующие значения температуры и давления:
Т =0°С (273 К);
р =760 мм ртутного столба (мм Hg) или 101.3 кПа.
В табл. 4.1 приняты следующие обозначения:
М – относительная молекулярная масса;
r – плотность газовой фазы, кг/м3;
R – удельная газовая постоянная Дж/(кг×К);
V M – молярный объем (объем килограмм–моля) газа при нормальных физических условиях, м3/кмоль.
Как следует из табл. 4.1, в 1 м3 воздуха содержится 0.21 м3 кислорода, следовательно, на 1 м3 кислорода приходится Vв =1/0.21=4.762 м3 воздуха. Соответственно, на 1 кг кислорода приходится mв =1/0.23=4.348 кг воздуха. Если процесс горения происходит с участием воздуха, параметры которого отличаются от нормальных (Т ¹ 00С и р ¹ 760 мм Hg), то плотность воздуха рассчитывается с помощью уравнения состояния (уравнения Менделеева–Клапейрона):
 , (4.1)
, (4.1)
где Т – абсолютная температура.
Уравнение состояния (4.1) для нормальных условий записывается в виде
 , (4.2)
, (4.2)
где pн, r н, Rн, Тн – значения соответствующих параметров при нормальных физических условиях.
В предположении R= Rн=const, разделив (4.1) на (4.2), можно получить формулы для расчета плотности воздуха при произвольных значениях p, T.
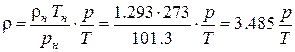 , (4.3)
, (4.3)
если давление выражено в кПа.
 , (4.4)
, (4.4)
если давление выражено в мм Hg.
Аналогично можно получить формулы для расчета молярного объема воздуха при произвольных значениях p, T.
 , (4.5)
, (4.5)
если давление выражено в кПа.
 , (4.6)
, (4.6)
если давление выражено в мм Hg.
Единицы давления связаны следующими соотношениями:
1 мм Hg = 133.3 Па; 1 Па = 0.0075 мм Hg.
Формулы, подобные (4.3)–(4.6), можно получить для любых газообразных компонентов горючей смеси и газообразных продуктов горения по известным физическим параметрам газов при нормальных физических условиях.
Поиск по сайту: